题目内容
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
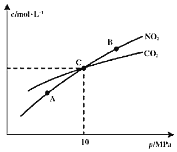
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
【答案】N2![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)N2H4易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为:N2H4·H2O![]() N2H5++OH-;
N2H5++OH-;
(2)①平衡常数只受温度影响,所以Kc(A)=Kc(B);
②增大压强平衡向气体体积减小的方向移动,该反应的正反应是气体体积增大的反应,所以A、B、C三点中NO2的转化率最高的是A点;
③在C点时,CO2与NO2的浓度相等,根据反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g),可知N2的浓度为CO2的一半,所以混合气体中CO2的体积分数为
N2(g)+2CO2(g),可知N2的浓度为CO2的一半,所以混合气体中CO2的体积分数为![]() ,NO2的体积分数
,NO2的体积分数![]() ,N2的体积分数
,N2的体积分数![]() ,所以反应的压强平衡常数KP=
,所以反应的压强平衡常数KP=![]() =
=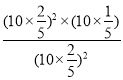 MPa=2MPa;
MPa=2MPa;
(3)由HNO2的电离平衡常数Ka=5.1×10-4,H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11,可知溶液中完全反应生成等物质的量的Na2CO3、NaHCO3和NaNO2,可判断水解程度大小顺序为CO32->HCO3->NO2-,CO32-水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-的浓度大小关系为:c(HCO3-)> c(NO2-)> c(CO32-);
(4)CH3NH2+H2O![]() CH3NH3++OH-的Kb=
CH3NH3++OH-的Kb=![]() ,向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,Kb=c(OH-)=10-3.4mol/L,c(H+
,向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,Kb=c(OH-)=10-3.4mol/L,c(H+![]() =10-10.6mol/L,pH=10.6;
=10-10.6mol/L,pH=10.6;
(5)由盖斯定律可知将②-①可得△H=-189.2kJ·mol-1-(+210.5kJ·mol-1)=-399.7kJ·mol-1,则CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-399.7kJ·mol-1。
CaS(s)+3CO2(g) △H=-399.7kJ·mol-1。