题目内容
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。利用湿法、干法制备高铁酸盐的原理如表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上利用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
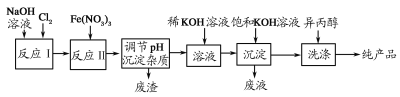
①反应Ⅰ的化学方程式为_____________。
②反应Ⅱ的离子方程式为_______________。
③加入饱和KOH溶液的目的_____________。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为___________。
(3)干法制备K2FeO4的反应中,氧化剂是________。
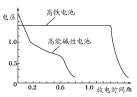
(4)高铁电池是正在研制中的可充电干电池,如图为该电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________、________。
【答案】2NaOH+Cl2=NaCl+NaClO+H2O 3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O 增大K+浓度,促进K2FeO4晶体析出 高铁酸钾有强氧化性,能杀菌消毒,且其被还原生成的Fe3+水解生成Fe(OH)3,具有吸附性和絮凝作用 KNO3 使用时间长 工作电压稳定
【解析】
由流程可知,反应Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,加入硝酸铁在碱溶液中发生氧化还原反应生成Na2FeO4,除杂后,由于高铁酸钠溶解度大于高铁酸钾溶解度,再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,用异丙醇洗涤得到产品。
(1)①反应Ⅰ是氢氧化钠和氯气反应生成氯化钠、次氯酸钠、水,反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O;
②反应Ⅱ是强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸钠,根据得失电子守恒,反应的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
③Na2FeO4+2KOH![]() K2FeO4+2NaOH,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,析出K2FeO4晶体,加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出;
K2FeO4+2NaOH,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,析出K2FeO4晶体,加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出;
(2)高铁酸钾中铁元素化合价为+6,高铁酸钾有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成Fe(OH)3,具有吸附性和絮凝作用,所以高铁酸钾是一种理想的水处理剂;
(3)干法制备K2FeO4的反应中Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸钾和KNO2,铁元素化合价升高、N元素化合价由+5降低为+3,氧化剂是KNO3。
(4)由该电池和常用的高能碱性电池的放电曲线可知,高铁电池的优点有:使用时间长、工作电压稳定。

【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作 | 现象 | 结论 | |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有 |
B | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试管不变蓝 | 原溶液中无 |
A.AB.BC.CD.D