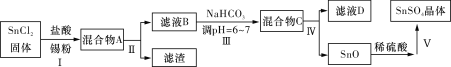
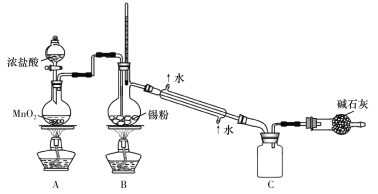
题目内容
【题目】常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
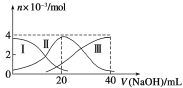
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-) >c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2∶1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
【答案】B
【解析】
试题分析:A.根据图象知,当V(NaOH)=20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶质主要为NaHA,HA-电离程度大于水解程度,溶液显酸性,水和HA-都电离出氢离子,只有HA-电离出A2-,所以离子浓度大小顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故A错误;B.等浓度的NaOH溶液与H2A溶液按体积2:1混合后,二者恰好反应生成Na2A和水,Na2A是强碱弱酸盐促进水电离,故B正确;C.根据电荷守恒得c(OH-)+2c(A2-)+c(HA-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(HA-)+c(H2A)+c(A2-),所以得c(OH-)+c(A2-)=c(H+)+c(H2A),故C错误;D.二者恰好反应生成NaHA,加水稀释HA-电离和水解,但氢氧根离子浓度减小,但水解程度大于电离程度,所以pH增大,故D错误;故选B。

【题目】下述实验能达到预期目的的是( )
编号 | 实验内容 | 实验目的 |
A | 将Na2CO3和NaHCO3 的固体混合物加热灼烧 | 除去NaHCO3中的Na2CO3 |
B | 常温时将CO通过装有SiO2 的硬质玻璃管 | 制取粗硅 |
C | 向新制得的K2S溶液中滴加新制的氯水 | 比较氯与硫的得电子能力 |
D | 分别向2支盛有冷水的试管中加入相同大小的镁条和铝条。 | 比较镁铝的金属性强弱 |