题目内容
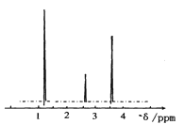
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___(填“酸性”、“中性”或“碱性”或“无法确定”),理由是_______。
(2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填序号)。
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是________0.11 mol·L-1(填“<”、“>”或“=”); 理由是__________。
【答案】酸性 H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解 bc 小于 0.1 mol/L NaHB溶液的pH=2,说明其中c(H+)=0.01 mol/L,主要是HB-电离产生的,在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1 mol/L H2B溶液中c(H+)<0.11 mol·L-1
【解析】
(1)H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,导致溶液中c(H+)>c(OH-),所以溶液呈酸性;
(2)a.水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数也未知,故a错误;
b.溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性,氢离子浓度等于氢氧根离子浓度,所以c(Na+)+c(K+)=c(HB-)+2c(B2-),故b正确;
c.NaHB溶液呈酸性,Na2B溶液呈碱性,向0.1 mol·L-1 的NaHB溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性时,NaHB的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故c正确;
d.NaHB溶液呈酸性,Na2B溶液呈碱性,向0.1 mol·L-1 的NaHB溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性时,c(Na+)+c(K+)=0.10 mol·L-1 ,为定值,故d错误,答案为bc;
(3)若0.1 mol·L-1NaHB溶液的pH=2,说明溶液中c(H+)=0.01 mol·L-1 ,则HB-的电离度是10%,H2B第一步不能完全电离,第二步部分电离,由于H2B第一步电离产生的H+抑制了HB-的电离,故H2B(0.1 mol·L-1 )的c(H+)小于0.11 mol·L-1 。

 名校课堂系列答案
名校课堂系列答案【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作 | 现象 | 结论 | |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有 |
B | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试管不变蓝 | 原溶液中无 |
A.AB.BC.CD.D