题目内容
17.我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.(1)NH3、CO2与饱和食盐水反应,能析出碳酸氢钠晶体的原因是c.
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).
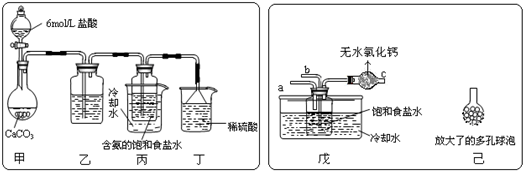
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是饱和碳酸氢钠溶液;
(Ⅱ)丁装置中稀硫酸的作用是吸收未反应的NH3;
(Ⅲ)实验结束后,分离出NaHCO3 的操作是过滤(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入NH3 气体,再从b管中通入CO2气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是增大气体与溶液接触面积,提高CO2吸收率;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:用碳酸氢铵与适量饱和食盐水反应,或往烧碱溶液中通入过量CO2;或往饱和Na2CO3溶液中通入过量CO2 等.
分析 (1)依据题干中信息碳酸氢钠溶解度相对较小分析判断;
(2)①(I)依据用盐酸制取二氧化碳时常会含有氯化氢气体分析即可解答;
(II)依据稀硫酸能与氨气反应分析解答;
(Ⅲ)依据分离固体与液体采用的实验操作分析解答;
②(I)根据氨气易溶于水,从制取碳酸氢钠时先要得到含氨的饱和食盐水分析解答;
(II)从装置改动后反应物的接触面积变大分析判断;
(3)从题干信息以及所学的制取碳酸氢钠的知识解答.
解答 解:(1)a.碳酸氢钠易溶于水,故错误;
b.碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,故错误;
c.碳酸氢钠的溶解度相对于氯化铵来说碳酸氢钠的溶解度更小一些,所以在溶液中首先结晶析出,故正确;
故答案为:c;
(2)①(I)利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,故答案为:饱和碳酸氢钠溶液;
(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,故答案为:吸收未反应的NH3;
(Ⅲ)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,故答案为:过滤;
②(I)制取碳酸氢钠时先要得到含氨的饱和食盐水,氨气极易溶于水,二氧化碳能溶于水,所以应先通入氨气,所以a端通入,从而保证了从b通入二氧化碳时,二氧化碳被充分反应,故答案为:a;NH3;b;CO2;
(II)装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率,故答案为:增大气体与溶液接触面积,提高CO2吸收率解;
(3)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,同时也可采用烧碱溶液中通入过量CO2或往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠,故答案为:用碳酸氢铵与适量饱和食盐水反应,或往烧碱溶液中通入过量CO2;或往饱和Na2CO3 溶液中通入过量CO2等.
点评 本题主要考查“侯氏制碱法”的反应原理,题目较为综合,难度较大,解答须明晰制碱的原理.

| 选项 | 反应 | 反应 |
| A | 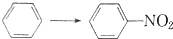 | CH2═CH2→CH3CH2Cl |
| B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
| C | CH3CH2OH→CH2═CH2 | CH3CH2OH→CH3CHO |
| D | 油脂→甘油 |  |
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 陈述 | 陈述 |
| A | H2O2、SO2都能使酸性高锰酸钾溶液褪色 | 前者表现出还原性后者表现出漂白性 |
| B | 纯银器表面在空气中渐渐变暗 | 发生化学腐蚀 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | BaSO4饱和溶液中加入饱和Na2CO3 溶液有BaCO3生产 | 说明Kvp(BaSO4)>Kvp(BaSO3) |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 电解精炼铜:阳极质量的减小等于阴极质量的增加 | |
| B. | 氯碱工业:在阴极需要不断加入含有NaOH的蒸馏水 | |
| C. | 合成氨工业:使用催化剂只加快反应速率不影响化学平衡 | |
| D. | 硫酸工业:SO2的转化率高达93.5%~98%,因此接触氧化后的尾气可以直接排放 |