题目内容
9.下列陈述I、陈述Ⅱ均正确并且有因果关系的是( )| 选项 | 陈述 | 陈述 |
| A | H2O2、SO2都能使酸性高锰酸钾溶液褪色 | 前者表现出还原性后者表现出漂白性 |
| B | 纯银器表面在空气中渐渐变暗 | 发生化学腐蚀 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | BaSO4饱和溶液中加入饱和Na2CO3 溶液有BaCO3生产 | 说明Kvp(BaSO4)>Kvp(BaSO3) |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A、过氧化氢和二氧化硫钡高锰酸钾溶液氧化,表现了还原性;
B、银和空气中氧气氧化表面变暗;
C、二氧化硅属于酸性氧化物,和氢氟酸反应是特性;
D、离子浓度积大于等于溶度积可以沉淀;
解答 解:A、H2O2、SO2都能使酸性高锰酸钾溶液褪色,表现出过氧化氢和二氧化硫的还原性,不是二氧化硫的漂白作用,故A错误;
B、纯银器表面在空气中渐渐变暗,银和空气中氧气氧化表面变暗,发生化学腐蚀,故B正确;
C、二氧化硅和氢氟酸反应是二氧化硅的特性,属于酸性氧化物,故C错误;
D、BaSO4饱和溶液中加入饱和Na2CO3溶液有BaCO3生产,是因为碳酸根离子浓度和钡离子浓度乘积大于等于碳酸钡溶度积,会形成碳酸钡沉淀,不能证明溶度积常数大小,故D错误;
故选B.
点评 本题考查了物质性质的分析应用,主要是二氧化硅、过氧化氢等物质性质的分析,溶度积常数和沉淀转化的原理分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
8.某有机物的结构简式如图此有机物的说法不正确的是( )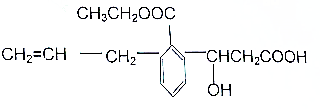

| A. | 可发生的反应类型有:取代、加成、消去、酯化、水解、氧化、中和、聚合 | |
| B. | 1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为2mol | |
| C. | 1mol该物质与Na、Na2CO3、NaHCO3反应时,所消耗的物质的量之比为2:1:2,产生的气体在标准状况下的体积比是2:1:2 | |
| D. | 该有机物属于芳香族化合物 |
4.下列说法错误的是( )
| A. | 浓盐酸易挥发,盛在无色密封的玻璃瓶中 | |
| B. | 久置浓硝酸呈黄色,消除黄色的方法是向溶液中加水 | |
| C. | 除去C02中混有的S02:用饱和NaHC03溶液洗气,再干燥 | |
| D. | 液溴易挥发,盛放在用水密封的用玻璃塞塞紧的棕色试剂瓶中 |
18.下列物质所含原子总数为1mol的是( )
| A. | 10gH2 | B. | 16gCH4 | C. | 20gSO3 | D. | 17gNH3 |