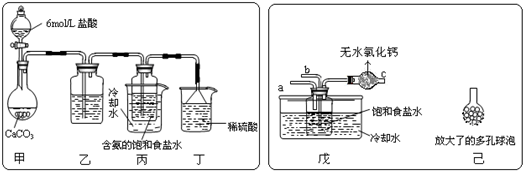
题目内容
2.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol
2H2S(g)=2H2(g)+S2(g)△H=+169.8kJ/mol
①以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与 H2O(g)反应生成 CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0kJ•mol-1.
②H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是为H2S热分解反应提供热量;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式2H2S+SO2═2H2O+3S.
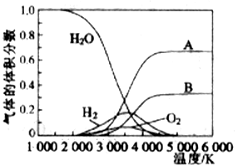
③H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示.图中A、B表示的物质依次是氢原子、氧原子.
④Mg2Cu是一种储氢合金.350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077).Mg2Cu与H2反应的化学方程式为:2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2.
分析 ①根据盖斯定律,利用已知热化学方程式乘以合适的系数进行加减,反应热也乘以相应的系数进行相应的计算,据此书写;
②使部分H2S燃烧放出热量,为H2S热分解反应提供热量;SO2与H2S进一步反应,生成物在常温下均非气体,二者反应生成S与H2O;
③由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,据此判断;
④令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2.
解答 解:①已知:
①CH4(g)+H2O(g)═CO(g)+3H2 (g)△H=-206.2kJ•mol-1
②CH4(g)+CO2 (g)═2CO(g)+2H2 (g)△H=-247.4kJ•mol-1
由盖斯定律,①×2-②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ•mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ•mol-1;
②使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,SO2与H2S进一步反应,生成物在常温下均非气体,二者反应生成S与H2O,
反应方程式为2H2S+SO2═2H2O+3S,
故答案为:为H2S热分解反应提供热量;2H2S+SO2═2H2O+3S;
③由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢原子、B为氧原子,故答案为:氢原子、氧原子;
④令金属氢化物为RHx,金属R的相对分子质量为a,则$\frac{x}{a+x}$=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2,
故答案为:2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2.
点评 本题考查热化学方程式的书写、常用化学用语书写等方面的知识,注意知识的迁移和应用是关键,难度不大.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 某酸性溶液中,HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、Na+可大量共存 | |
| B. | NA表示阿伏加德罗常数,则常温常压下,3.0g乙烷中含有的碳氢键数为0.6NA | |
| C. | 实验室中,常用玻璃瓶盛放氢氟酸 | |
| D. | 用饱和NaHCO3溶液可除去CO2中的HCl气体 |
| A. | X的值为1 | |
| B. | M的平均反应速率为0.15 mol•L-1•min-1 | |
| C. | M的转化率为60% | |
| D. | 平衡时P的浓度为0.25 mol•L-1 |
| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,44g CO2中含有的分子数为NA | |
| C. | 在常温常压下,22.4L Cl2含有的分子数为1.0NA | |
| D. | 在标准状况下,22.4L H2O含有的分子数为1.0NA |
| A. | 向NH4Al(S04)2溶液中滴加过量Ba(OH)2溶液:2Ba2++40H-+2S042-+Al3+=2BaS04↓+2H20+Al02- | |
| B. | 向NaHS04溶液中滴Ba(OH)2溶液至S042-完全沉淀:2 H++S042-+Ba2++20H-=BaS04↓+2H20 | |
| C. | 向0.1mol.L-l、pH=l的NaHA溶液中加入NaOH溶液:HA-十OH-=A2-+H20 | |
| D. | 向1L lmol.L-1的FeBr2溶液中通等物质的量Cl2:2Cl2+2Fe2++2Br-=4Cl-十2Fe3++Br2 |
| A. | 将溶解溶质的烧杯内的液体倒入容量瓶后,未洗涤烧杯就进行定容. | |
| B. | 定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸出 | |
| C. | 定容摇匀后,发现瓶内液面略低于瓶颈刻度线 |