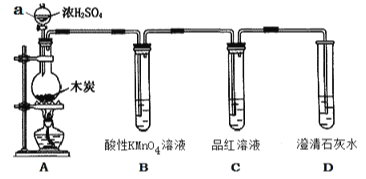
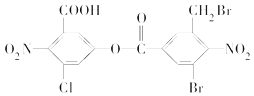
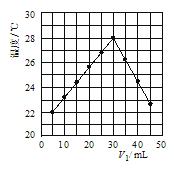
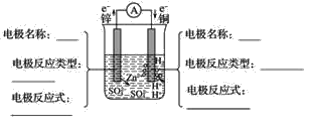
题目内容
【题目】下表列出了9种元素在元素周期表中的位置示意。
周期 | ⅠA 1 | 0 18 | ||||||
1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | |||||
4 | ⑨ | |||||||
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______(填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
【答案】![]() 或
或![]()
![]()
![]() 离子键和极性键 HF 2Na+2H2O=2Na++2OH-+H2↑ Cl2+2Br=Br2+2Cl-
离子键和极性键 HF 2Na+2H2O=2Na++2OH-+H2↑ Cl2+2Br=Br2+2Cl-
【解析】
根据周期表提供的信息可知,①为Li ②C ③N④S⑤F ⑥Na ⑦Si⑧Cl ⑨Br;根据以上各元素及其形成的化合物的性质进行分析。
(1)考古时利用![]() 测定一些文物的年代;
测定一些文物的年代;
故答案为:![]() 或
或![]() ;
;
(2)元素⑧为17号元素,其形成的简单离子为Cl-,其结构示意图为:![]() ;
;
故答案为:![]()
(3)元素④为O,元素⑥为Na,其对应单质在加热条件下反应生成Na2O2,其电子式为:![]() ;
;
故答案为:![]()
(4)Na元素最高价氧化物对应的水化物为NaOH,所含微粒为Na+、OH-,因此NaOH中含有的化学键是离子键和极性键;
故答案为:离子键和极性键;
(5)②、③、④、⑤为同周期元素,从左到右,其元素非金属性逐渐增加,简单气态氢化物的稳定性逐渐增加,故稳定性最强的是HF;元素⑥为Na,其与水反应生成氢氧化钠、氢气,其离子反应方程式为:2Na+2H2O=2Na++2OH-+H2↑;元素⑧为Cl,元素⑨为Br,可通过置换反应证明单质氧化性强弱,从而证明元素非金属性强弱,其反应的离子方程式为:Cl2+2Br=Br2+2Cl-;
故答案为:HF;2Na+2H2O=2Na++2OH-+H2↑;Cl2+2Br=Br2+2Cl-。

【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
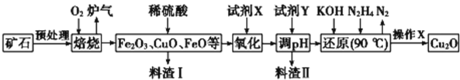
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。