题目内容
【题目】为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
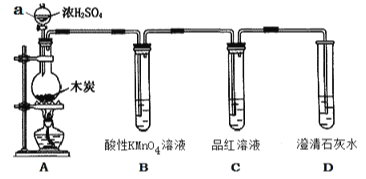
(1)仪器a的名称为:__________;在组装好上述实验装置后,在装入药品之前必需的实验操作是________________。
(2)写出A中发生反应的化学方程式____________________。该装置还可以用于实验室制取Cl2,请写出实验室制取Cl2的离子方程式并用单线桥标明电子转移________________。
(3)装置B的作用是____________________。
(4)能说明产物中一定存在CO2气体的实验现象为________________。
(5)质量分数为98%的浓硫酸,其密度为1.84g/ml,该浓硫酸的物质的量浓度为__________,用该硫酸配制500ml 0.5mol/L的稀硫酸,主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要____________,定容时由于俯视刻度线,则对浓度产生的影响为___________ (填“偏大”“偏小”或“无影响”)。
【答案】 分液漏斗 检查装置的气密性 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O ![]() 除去混合气体中二氧化硫 C中品红不褪色,D中溶液出现白色沉淀(或浑浊) 18.4mol/L 500 mL容量瓶 偏大
除去混合气体中二氧化硫 C中品红不褪色,D中溶液出现白色沉淀(或浑浊) 18.4mol/L 500 mL容量瓶 偏大
【解析】碳和浓硫酸在加热条件下反应生成SO2和CO2,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2除净,酸性高锰酸钾溶液用于吸收SO2,品红溶液用于检验SO2是否除净。
(1)由图可知仪器a为分液漏斗,在组装好上述实验装置后,在装入药品之前必须检验装置的气密性;(2)装置A中发生的反应为C和浓硫酸共热生SO2、CO2和水,化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;实验室制取Cl2的离子方程式为:MnO2+4H+2Cl-
CO2↑+2SO2↑+2H2O;实验室制取Cl2的离子方程式为:MnO2+4H+2Cl-![]() Mn2++Cl2↑+2H2O,每1mol MnO2转移2mol电子,用单线桥标明电子转移:
Mn2++Cl2↑+2H2O,每1mol MnO2转移2mol电子,用单线桥标明电子转移:![]() ;(3)用澄清石灰水检验CO2之前必须把SO2吸收干净,故装置B的作用是除去混合气体中二氧化硫;(4)C中品红溶液不褪色,说明SO2除干净,D中澄清的石灰水变浑浊,即可说明产物中一定存在CO2气体;(5)设质量分数为98%密度为1.84g/mL的浓硫酸1L,则其物质的量浓度为:
;(3)用澄清石灰水检验CO2之前必须把SO2吸收干净,故装置B的作用是除去混合气体中二氧化硫;(4)C中品红溶液不褪色,说明SO2除干净,D中澄清的石灰水变浑浊,即可说明产物中一定存在CO2气体;(5)设质量分数为98%密度为1.84g/mL的浓硫酸1L,则其物质的量浓度为:![]() =18.4mol/L,用该硫酸配制500mL 0.5mol/L的稀硫酸,主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要500 mL容量瓶,定容时由于俯视刻度线,则所加蒸馏水的体积偏小,浓偏大。
=18.4mol/L,用该硫酸配制500mL 0.5mol/L的稀硫酸,主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要500 mL容量瓶,定容时由于俯视刻度线,则所加蒸馏水的体积偏小,浓偏大。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案