题目内容
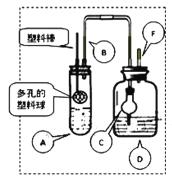
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
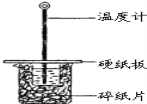
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;
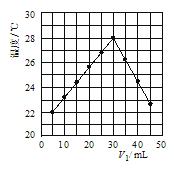
(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
【答案】(1)D (2)ABD (3)ΔH1>ΔH2=ΔH3 (4)1.5mol/L
【解析】
试题分析:(1)A.该实验也可在保温杯中进行,A正确;B.图中实验装置缺少环形玻璃搅拌棒,B正确;C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失,C正确;D.若将盐酸体积改为60mL,两次实验所求得中和热相等,D错误,答案选D。
(2)A.实验装置保温、隔热效果差,导致热量损失,测量值减小,A正确;B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中导致热量损失,测量值减小,B正确;C.量取NaOH溶液的体积时仰视读数,实际量取的体积增加,测量值偏大,C错误;D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度,导致氢氧化钠减少,放出的热量减少,测量值减小,D正确。答案选ABD。
(3)弱电解质中才电离平衡,电离吸热,所以实际放出的热量减少,放热越少,△H越大,则ΔH1、ΔH2、ΔH3的大小关系为ΔH1>ΔH2=ΔH3;
(4)温度最高时说明二者恰好完全反应,所以氢氧化钠的浓度为![]() =1.5mol。
=1.5mol。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】二甲氧基甲烷[CH2(OCH3)2]水溶性好、含氧量高、燃烧完全、烟气排放量低,被认为是一种极具应用前景的柴油添加剂。工业生产CH2(OCH3)2一般是在催化剂作用下,将37%的甲醛(HCHO)水溶液和甲醇(CH3OH)混合共热,反应原理如下:HCHO+2CH3OH![]() CH2(OCH3)2+H2O
CH2(OCH3)2+H2O
(1)某次研究反应时间对产率的影响的实验中,CH2(OCH3)2的浓度随反应时间变化如表:
时间(min) | 20 | 25 | 30 | 40 | 50 | 60 |
CH2(OCH3)2 (mol/L) | 9.02 | 9.10 | 9.18 | 9.23 | 9.30 | 9.32 |
计算25~50min中CH2(OCH3)2的平均生成速率为___。
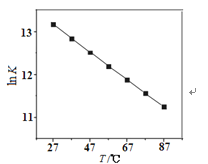
(2)研究反应的化学平衡常数(记作lnK)与温度(T)的关系如图所示,判断该反应的△H___0(填“>”、“<”、“=”)。
(3)假设在密闭容器中发生上述反应:
①达到平衡时下列措施能提高HCHO转化率的是___。
A.及时从反应体系中分离出CH2(OCH3)2
B.升高反应体系的温度
C.再添加适量甲醇
D.再添加一定量甲醛
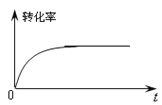
②下图是催化剂作用下甲醇转化率随时间变化的趋势曲线图。请在图中用虚线画出相同条件下,不使用催化剂时转化率随时间变化的曲线。___
(4)进一步研究发现:甲醛的滴加速率、反应时间、催化剂的量和搅拌速率等对CH2(OCH3)2的工业实际产率(不完全是平衡状态下得出的)也会产生一定影响。欲分别研究甲醛的滴加速率、搅拌速率对产率的影响,某同学设计了三组实验如表:
影响因素 实验号 | 甲醛的滴加速率(g/min) | 反应时间(min) | 催化剂的量(g) | 搅拌速率(r/min) |
1 | ___ | 70 | 2.5 | 30 |
2 | 1.0 | ___ | ___ | ___ |
3 | 2.5 | ___ | ___ | 80 |
①请在上表空格中填入剩余的实验条件数据。
②在研究过程中发现,甲醛(HCHO)的滴加速率过慢或过快均会使CH2(OCH3)2产率降低。请结合该反应的合成机理:HCHO![]() HOCH2OCH3
HOCH2OCH3![]() CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
CH2(OCH3)2,试分析甲醛的滴加速率过快时,导致产率较低的原因可能是___。
【题目】下表列出了9种元素在元素周期表中的位置示意。
周期 | ⅠA 1 | 0 18 | ||||||
1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | |||||
4 | ⑨ | |||||||
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______(填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________