题目内容
9.某有机物,它的相对分子质量为60. 6.0g该有机物完全燃烧后的产物通过浓硫酸后增重7.2g,通过足量澄清石灰水后有30g白色沉淀生成.求:(1)该有机物的分子式;
(2)写出能与钠反应的该有机物的所有同分异构体的结构简式.
分析 (1)浓硫酸增重的为水的质量,通过足量澄清石灰水后有30g白色沉淀生成,可以求出二氧化碳的物质的量,根据该有机物燃烧产物可计算有机物的实验式,再根据相对分子质量可计算并写出分子式;
(2)分子式为C3H8O能够与钠反应,说明分子中含有羟基,根据该有机物分子式写出可能的结构简式.
解答 解:(1)使浓硫酸增重可知水的质量为7.2g,可计算出n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,n(H)=0.8mol,m(H)=0.8g;通过足量澄清石灰水后有30g白色沉淀生成,该白色沉淀为碳酸钙,则n(C)=n(CaCO3)=$\frac{30g}{100g/mol}$=0.3mol,m(C)=3.6g,m(C)+m(H)=4.4g,因有机物的质量为6.0g,所以有机物中氧元素的质量为:6.0g-4.4g=1.6g,n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,n(C):n(H):n(O)=0.3mol:0.8mol:0.1mol=3:8:1,即实验式为C3H8O,设分子式为(C3H8O)n,又A的相对分子质量为60,解得n=1,该有机物分子式为:C3H8O,
答:有机物的分子式为:C3H8O;
(2)分子式为C3H8O,且与钠反应,说明分子中含有羟基,该有机物属于醇类,结构简式:CH3CH2CH2OH与 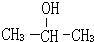 ;
;
答:能与钠反应的该有机物的所有同分异构体的结构简式:CH3CH2CH2OH与 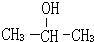 .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度知识,注意掌握确定有机物分子式、结构简式的计算方法,明确质量守恒定律在计算中的应用.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
19.心酮胺是治疗冠心病的药物,它具有如下结构简式.下列关于心酮胺的叙述错误的是( )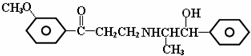
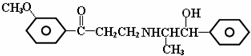
| A. | 可以发生加成反应 | B. | 可以发生消去反应 | ||
| C. | 可以发生银镜反应 | D. | 可以发生酯化反应 |
20.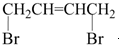 可经三步反应制取
可经三步反应制取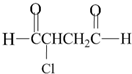 ,发生反应的类型依次是( )
,发生反应的类型依次是( )
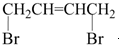 可经三步反应制取
可经三步反应制取 ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A. | 水解反应、加成反应、氧化反应 | B. | 加成反应、水解反应、氧化反应 | ||
| C. | 水解反应、氧化反应、加成反应 | D. | 加成反应、氧化反应、水解反应 |
17.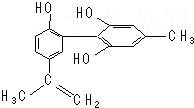 我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有原子有可能共平面 | |
| D. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
4.在常温常压下,等物质的量的下列物质完全燃烧,消耗氧气最多的是( )
| A. | 甲烷 | B. | 乙醇 | C. | 苯 | D. | 乙酸乙酯 |
14.NOx是大气污染的主要污染物之一.
(1)硝酸厂常用如下三种方法处理氮氧化物(NO与NO2)尾气
①催化还原法:在催化剂存在时用H2将NO2还原为N2,
②Na2CO3溶液吸收法:用Na2CO3溶液吸收NO2生成CO2,若9.2g NO2和Na2CO3溶液完全反应时转移0.1mol电子,则反应的离子方程式为2NO2+CO32-=NO3-+NO2-+CO2.
③烧碱吸收法:氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O,现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收.已知反应后溶液中含有0.35mo1NaNO2,若将尾气中NO与NO2的平均组成记为NOx,则x=1.8.
(2)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如表:
①稀硝酸的浓度为4mol•L-1
②计算原混合物中铁和铜的物质的量比为2:1;
③加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
(1)硝酸厂常用如下三种方法处理氮氧化物(NO与NO2)尾气
①催化还原法:在催化剂存在时用H2将NO2还原为N2,
②Na2CO3溶液吸收法:用Na2CO3溶液吸收NO2生成CO2,若9.2g NO2和Na2CO3溶液完全反应时转移0.1mol电子,则反应的离子方程式为2NO2+CO32-=NO3-+NO2-+CO2.
③烧碱吸收法:氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O,现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收.已知反应后溶液中含有0.35mo1NaNO2,若将尾气中NO与NO2的平均组成记为NOx,则x=1.8.
(2)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如表:
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 | 8960mL |
②计算原混合物中铁和铜的物质的量比为2:1;
③加入400mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为1.2mol.
18.日本福岛核电站事故发生后,在广东产蔬菜中检测到的极微量放射性${\;}_{53}^{131}$I,对公众健康没有影响,无需采取防护措施,公众不必担心.下列对该粒子的说法不正确的是( )
| A. | 质量数131 | B. | 核外电子数131 | C. | 原子序数53 | D. | 核内有78个中子 |
19.在下列各组物质中,属于同系物的是( )
| A. | 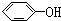 与 与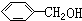 | B. | CH4与C3H8 | ||
| C. | 乙二醇和丙三醇 | D. | CH3CH=CHCH3 和CH2=C(CH3)2 |