��Ŀ����
14��NOx�Ǵ�����Ⱦ����Ҫ��Ⱦ��֮һ����1�����᳧�����������ַ��������������NO��NO2��β��
�ٴ���ԭ�����ڴ�������ʱ��H2��NO2��ԭΪN2��
��Na2CO3��Һ���շ�����Na2CO3��Һ����NO2����CO2����9.2g NO2��Na2CO3��Һ��ȫ��Ӧʱת��0.1mol���ӣ���Ӧ�����ӷ���ʽΪ2NO2+CO32-=NO3-+NO2-+CO2��
���ռ����շ����������NO��NO2�����ռ�������գ�����ΪNaNO2��NaNO3��H2O�����к�0.5mol���������β����ǡ�ñ�һ�������25%NaOH��Һ���ܶ�1.28g/cm3����ȫ���գ���֪��Ӧ����Һ�к���0.35mo1NaNO2������β����NO��NO2��ƽ����ɼ�ΪNOx����x=1.8��
��2���ֽ�һ����������ͭ�Ļ�����Ϊ��������4�ݣ��ֱ�����Ũ�Ȳ�ͬ�����ϡ���ᣨ���跴Ӧ��ϡ����Ļ�ԭ����ֻ��NO�������������ڱ�״���µ������ʣ���������������
| ���������mL�� | 100 | 200 | 300 | 400 |
| ʣ����壨g�� | 18.0 | 9.6 | 0 | 0 |
| �ų�����������mL�� | 2240 | 4480 | 6720 | 8960mL |
�ڼ���ԭ�����������ͭ�����ʵ�����Ϊ2��1��
�ۼ���400mLϡ���ᣬ��Ӧ��ȫ����Һ����������ӵ����ʵ���Ϊ1.2mol��
���� ��1����n��NO2��=$\frac{9.2g}{46g/mol}$=0.2mol���÷�Ӧ��NO2����ԭ����NO3-��0.2molNO2��Ӧת��0.1mol���ӣ�������n��NO3-��=$\frac{0.1mol}{5-4}$=0.1mol����ʣ��0.1mol�������������������������ʣ���ת��0.1mol���ӣ�����������NԪ�ػ��ϼ�Ϊ+3�ۣ�����������ˮ��Һ�У�Ӧ��������������ӣ��ݴ���д���ӷ���ʽ��
�۸���Nԭ���غ��n��NaNO3��=n��NOx��-n��NaNO2��=0.5mol-0.35mol=0.15mol��
NO��NO2��NaOH��Һ��Ӧ����ʽΪ2NO2+2NaOH=NaNO2+NaNO3+H2O��NO+NO2+2NaOH=2NaNO2+H2O������0.15mol��������Ҫ0.3molNO2��ͬʱ����0.15mol�������ƣ�����0.2mol������������NO��NO2�����NaOH��Ӧ�õ��ģ��õ���0.2mol����������Ҫ0.1molNO2��0.1molNO������NO��NO2�����ʵ����ֱ���0.1mol��0.4mol���ٸ���Oԭ���غ����xֵ��
��2���ټ���100mL����ʱ��������ʣ�࣬˵�������ܽ����ɶ���������������ȫ��Ӧ������������NO��n��NO��=$\frac{2.24L}{22.4L/mol}$=0.1mol������NO����������֮��Ĺ�ϵʽΪ2NO----8HNO3���ݴ˼�������Ũ�ȣ�
��100-200mLʱ���ܽ��������=18.0g-9.6g=8.4g��������ʣ�࣬˵�����ɵĽ����������Ƕ��������ӣ�����n��NO��=$\frac{4.48L-2.24L}{22.4L/mol}$=0.1mol������ת�Ƶ����غ��n��������=$\frac{0.1mol����5-2��}{2-0}$=0.15mol������ƽ��Ħ������=$\frac{8.4g}{0.15mol}$=56g/mol�������ܽ����Fe��
200-300mLʱ���ܽ��������=9.6g-0=9.6g������n��NO��=$\frac{6.72L-4.48L}{22.4L/mol}$=0.1mol�������ܽ����ȫ��ͭ��
����ת�Ƶ����غ��n��������=$\frac{0.1mol����5-2��}{2-0}$=0.15mol������ƽ��Ħ������=$\frac{9.6g}{0.15mol}$=64g/mol�������ܽ����ȫ��Cu������ǡ�ú�200mL������ȫ��Ӧ��������������
��400mL��ϡ�����к�����������ʵ���Ϊ��4mol/L��0.4L=1.6mol�����ݷ�ӦFe+4HNO3=Fe��NO3��3+NO��+2H2O���������ȫ��Ӧ����������������������ʵ������ټ����ͭ��ȫ��Ӧ������������ʵ��������ݼ������ж��������������ټ������Һ�к��е���������ӵ����ʵ�����
���ݷ���ʽ�н�����NO�Ĺ�ϵʽ��������NO�����
��� �⣺��1����n��NO2��=$\frac{9.2g}{46g/mol}$=0.2mol���÷�Ӧ��NO2����ԭ����NO3-��0.2molNO2��Ӧת��0.1mol���ӣ�������n��NO3-��=$\frac{0.1mol}{5-4}$=0.1mol����ʣ��0.1mol�������������������������ʣ���ת��0.1mol���ӣ�����������NԪ�ػ��ϼ�Ϊ+3�ۣ�����������ˮ��Һ�У�Ӧ��������������ӣ���Ӧ�����ӷ���ʽΪ��2NO2+CO32-=NO3-+NO2-+CO2��
�ʴ�Ϊ��2NO2+CO32-=NO3-+NO2-+CO2��
�۸���Nԭ���غ��n��NaNO3��=n��NOx��-n��NaNO2��=0.5mol-0.35mol=0.15mol��NO��NO2��NaOH��Һ��Ӧ����ʽΪ2NO2+2NaOH=NaNO2+NaNO3+H2O��NO+NO2+2NaOH=2NaNO2+H2O������0.15mol��������Ҫ0.3molNO2��ͬʱ����0.15mol�������ƣ�����0.2mol������������NO��NO2�����NaOH��Ӧ�õ��ģ��õ���0.2mol����������Ҫ0.1molNO2��0.1molNO������NO��NO2�����ʵ����ֱ���0.1mol��0.4mol��β����NO��NO2��ƽ����ɼ�ΪNOx����x=$\frac{0.1mol��1+0.4mol��2}{0.5mol}$=1.8��
�ʴ�Ϊ��1.8��
��2���ټ���100mL����ʱ��������ʣ�࣬˵�������ܽ����ɶ���������������ȫ��Ӧ������������NO��n��NO��=$\frac{2.24L}{22.4L/mol}$=0.1mol������NO����������֮��Ĺ�ϵʽΪ2NO----8HNO3��c��HNO3��=$\frac{n}{V}$=$\frac{\frac{0.1mol}{2}��8}{0.1L}$=4mol/L��
�ʴ�Ϊ��4��
��100-200mLʱ���ܽ��������=18.0g-9.6g=8.4g��������ʣ�࣬˵�����ɵĽ����������Ƕ��������ӣ�����n��NO��=$\frac{4.48L-2.24L}{22.4L/mol}$=0.1mol������ת�Ƶ����غ��n��������=$\frac{0.1mol����5-2��}{2-0}$=0.15mol������ƽ��Ħ������=$\frac{8.4g}{0.15mol}$=56g/mol�������ܽ����Fe��
��0-100mL�ܽ������100-200mL�ܽ����������ȣ�����0-100mL�ܽ��FeΪ8.4g��
200-300mLʱ���ܽ��������=9.6g-0=9.6g������n��NO��=$\frac{6.72L-4.48L}{22.4L/mol}$=0.1mol�������ܽ����ȫ��ͭ��
����ת�Ƶ����غ��n��������=$\frac{0.1mol����5-2��}{2-0}$=0.15mol������ƽ��Ħ������=$\frac{9.6g}{0.15mol}$=64g/mol�������ܽ����ȫ��Cu������ǡ�ú�200mL������ȫ��Ӧ��������������
��n��Fe��=$\frac{8.4g+8.4g}{56g/mol}$=0.3mol��n��Fe����n��Cu��=0.3mol��0.15mol=2��1���ʴ�Ϊ��2��1��
��400mL��ϡ�����к�����������ʵ���Ϊ4mol/L��0.4L=1.6mol�����ݷ�ӦFe+4HNO3=Fe��NO3��3+NO��+2H2O��֪��0.3mol����ȫ��Ӧ������������ʵ���Ϊ0.3mol��4=1.2mol��0.15molͭ��ȫ��Ӧ������������ʵ���Ϊ0.15mol��$\frac{8}{3}$=0.4mol���ܹ���Ҫ����1.6mol���ᣬ˵������400mLϡ�����ǡ�÷�Ӧ������ͽ���ǡ�÷�Ӧ��������ͭ����������������Һ����������ӵ����ʵ���Ϊ0.3mol��3+0.15mol��2=1.2mol��
���ݷ���ʽ3Cu+8HNO3=3Cu��NO3��2+2NO��+4H2O��Fe+4HNO3=Fe��NO3��3+NO��+2H2O֪������n��NO��=n��Fe��+$\frac{2}{3}$n��Cu��=0.3mol+0.1mol=0.4mol���������=0.4mol��22.4L/mol=8960mL��
�ʴ�Ϊ��1.2mol��8960mL��
���� ���⿼������ļ��㡢���ӷ���ʽ����д�����ؿ���ѧ�����������������ѵ��ǣ�2������㣬��ȷÿһ�������ķ�Ӧ�ǽⱾ��ؼ�������ת�Ƶ����غ�����йؼ��㣬ע�����ʷ�Ӧ�Ⱥ�˳����Ŀ�Ѷ��еȣ�

| A�� | ���ԣ�HClO4��H2SO4��H3PO4 | B�� | �е㣺H2O��H2S��H2Se | ||
| C�� | ���ԣ�NaOH��Mg��OH��2��Al��OH��3 | D�� | �۵㣺���ʯ��NaCl���� |
| A�� | �ڶ���ӵ�ԭ��������ߵĵ���ͨ�������Զ�������ڻ | |
| B�� | ����������������������͵ĵ��Ӳ��ϣ�����ֻ��������M������N�� | |
| C�� | ������������������Ų���ȫ��ͬ�����仯ѧ����һ����ͬ | |
| D�� | ���������ֻ����8�����Ӳ��ȶ� |
| A�� | ������ʹ���Ը��������Һ��ɫ | B�� | �����ڶ���ȡ������ֻ��һ�� | ||
| C�� | ����ʹ������Ȼ�̼��Һ��ɫ | D�� | ���ĶԶ���ȡ������ֻ��һ�� |
| A�� | Al+HCl | B�� | Al+O2 | C�� | Al+MgO | D�� | Al+Fe2O3 |
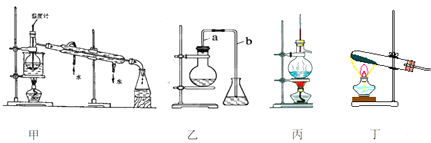
| A�� | װ�üף�ʯ�ͷ��� | B�� | װ���ң��屽����ȡ | ||
| C�� | װ�ñ�����ϩ����ȡ | D�� | װ�ö���������������ȡ |
 ��2-��-1-��ϩ��CH2=CH��CH3��CH2CH2CH3
��2-��-1-��ϩ��CH2=CH��CH3��CH2CH2CH3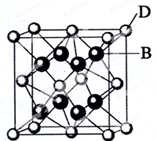 ��֪A��B��C��D��E����Ԫ�����ڱ���ǰ36��Ԫ�أ����ǵ�ԭ��������������A������4��Ԫ�ؼȲ���ͬһ�����ֲ���ͬһ���壮B��C��ͬһ���壬D��E��ͬһ���ڣ�D��ԭ��������EС5����֪E�����ڱ���1-18���еĵ�7��Ԫ�أ�D�ļ۵�����Ϊ2��D��B���γ����ӻ�����侧���ṹ��ͼ����ش�
��֪A��B��C��D��E����Ԫ�����ڱ���ǰ36��Ԫ�أ����ǵ�ԭ��������������A������4��Ԫ�ؼȲ���ͬһ�����ֲ���ͬһ���壮B��C��ͬһ���壬D��E��ͬһ���ڣ�D��ԭ��������EС5����֪E�����ڱ���1-18���еĵ�7��Ԫ�أ�D�ļ۵�����Ϊ2��D��B���γ����ӻ�����侧���ṹ��ͼ����ش�