题目内容
19.心酮胺是治疗冠心病的药物,它具有如下结构简式.下列关于心酮胺的叙述错误的是( )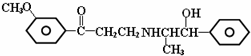
| A. | 可以发生加成反应 | B. | 可以发生消去反应 | ||
| C. | 可以发生银镜反应 | D. | 可以发生酯化反应 |
分析 含有苯环、醚键、羰基、氨基、醇羟基,所以具有苯、醚、胺、醇的性质,能发生加成反应、还原反应、氧化反应、消去反应、取代反应等,据此分析解答.
解答 解:A.含有苯环和羰基,所以能发生加成反应,故A正确;
B.连接醇羟基碳原子相邻碳原子上含有氢原子,所以能发生消去反应,故B正确;
C.不含醛基,所以不能发生银镜反应,故C错误;
D.含有醇羟基,所以能发生酯化反应,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系即可解答,侧重考查烯烃、酮、醇的性质,易错选项是C.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列叙述正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 氯化氢的电子式为: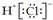 | ||
| C. | 甲烷的比例模型: | D. | 质量数为35的氯原子:1735Cl |
7.下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.
(1)在这10种元素中,化学性质最不活泼的是⑩(写序号),失电子能力最强的原子是K(用元素符号表示).
(2)在这10种元素中,最高价氧化物的水化物碱性最强的是KOH(填化学式),最高价氧化物的水化物酸性最强的是HClO4(填化学式).
(3)H分别与④、⑤、⑦、⑧、⑨形成的化合物中,最稳定的是HF(填化学式);
(4)①、⑧、⑨三种元素单核离子半径由小到大的顺序是(用相应的离子符号表示):Na+<F-<Cl-
(5)写出③和⑨形成的化合物的电子式: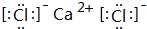 ,化学键类型为离子键(“离子键”或“共价键”).
,化学键类型为离子键(“离子键”或“共价键”).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑧ | ⑩ | |||
| 3 | ① | ⑦ | ⑨ | |||||
| 4 | ② | ③ |
(2)在这10种元素中,最高价氧化物的水化物碱性最强的是KOH(填化学式),最高价氧化物的水化物酸性最强的是HClO4(填化学式).
(3)H分别与④、⑤、⑦、⑧、⑨形成的化合物中,最稳定的是HF(填化学式);
(4)①、⑧、⑨三种元素单核离子半径由小到大的顺序是(用相应的离子符号表示):Na+<F-<Cl-
(5)写出③和⑨形成的化合物的电子式:
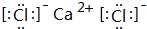 ,化学键类型为离子键(“离子键”或“共价键”).
,化学键类型为离子键(“离子键”或“共价键”).
14.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: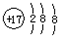 | B. | 氯化铵的电子式: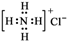 | ||
| C. | CO2的结构式:O=C=O | D. | CH4的比例模型: |
4.下列判断错误的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 熔点:金刚石>NaCl>冰 |
11.制备乙酸乙酯的装置如图所示,有关实验室制取乙酸乙酯的说法正确的是( )


| A. | 试剂添加的顺序为硫酸一乙醇一乙酸 | |
| B. | 无论怎样控制反应条件,1mol乙酸与1mol乙醇反应都不会生成1mol乙酸乙酯 | |
| C. | 试管B中盛有饱和氢氧化钠溶液来除去乙酸乙酯中的杂质,反应后可用分液方法分离 | |
| D. | 生成的乙酸乙酯和硬脂酸甘油酯互为同系物,都可以发生水解反应 |
8.用CH3CO18OH和CH3CH2OH发生酯化反应生成酯A.据此你对该反应所得出的结论是( )
| A. | 生成物中酯A的相对分子质量为88 | |
| B. | 18O全部进入水中 | |
| C. | 18O全部进入生成的酯中 | |
| D. | 酯A与H2O水解后在CH3COOH和CH3CH2OH都有18O存在 |