题目内容
【题目】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态电子排布式可表示为________。
(2)MX3-的空间构型是________(用文字描述)。H2X分子的VSEPR模型名称为________。
(3)含Z(H2X)42+的溶液中通入MH3,会生成Z(MH3)42+的原因___________________________。(从电负性角度解释)
(4) 1 mol WX2中含有的π键数目为________。
(5) AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______。
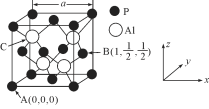
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为____________ g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的数值)。
【答案】1s22s22p63s23p63d3或[Ar]3d3 平面正三角形 四面体形 H2O中O的电负性大,不易提供孤电子对形成配位键 2NA 原子晶体 (1/4,1/4,3/4) ![]()
【解析】
用来鉴定文物年代的是14C,所以W为碳元素;能在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭的单质是臭氧,所以X是氧元素;M的氧化物是导致酸雨的主要物质之一,所以M是氮元素或硫元素,依原子序数依次增大可确定M为氮元素;Y的基态原子核外有6个原子轨道处于半充满状态,所以Y为铬元素;Z能形成红色的和黑色的两种氧化物,Z为铜元素。
(1)铬离子的基态电子排布式可表示为:[Ar]3d3;
(2)NO3-的空间构型是平面三角形,H2O的价电子互斥模型名称为四面体型;
(3)Cu(H2O)42+的溶液中通入氨气,会形成Cu(NH3)42+,这是因为氧的电负性大于氮原子且半径相对较小,相对来说较难提供孤电子对以形成配位键,所以配体水分子被氨气分子替换;
(4)双键中含有1个π键,因此1molCO2中含有π键的数目为2NA;
(5)①AlP晶体的熔点高,则推测其为原子晶体;
②A点、B点的坐标分别为(0,0,0)和(1,1/2,1/2),由此可推知C点的坐标为(![]() );据均摊点分析可知该晶体每个晶胞中含有4个P原子,4个铝原子。据
);据均摊点分析可知该晶体每个晶胞中含有4个P原子,4个铝原子。据![]() g/cm3。
g/cm3。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案