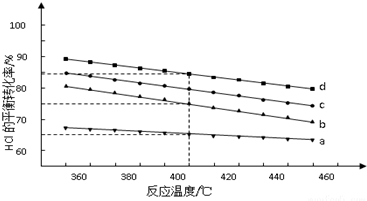
题目内容
4.在NH4Cl饱和溶液中分别加入①Mg;②NH4Cl(固);③NH4HCO3;④H2O;⑤氯水;⑥Cu.能使该溶液的pH值增大的是( )| A. | ②③ | B. | ①②⑤ | C. | ②③⑥ | D. | ①③④ |
分析 在NH4Cl饱和溶液中存在NH4++H2O?NH3.H2O+H+,
加入的物质如果能和H+反应,则促进氯化铵水解,溶液中c(H+)降低,pH增大;
如果加入的物质不影响NH4+水解,则溶液的pH不变;
如果加入的物质抑制NH4+水解,则溶液中c(H+)减小,溶液的pH增大;
如果加入的物质导致溶液中c(H+)增大,则溶液的pH减小,据此分析解答.
解答 解:NH4Cl饱和溶液中存在NH4++H2O?NH3.H2O+H+,
①Mg可以H+反应:Mg+2H+=Mg2++H2↑,氢离子参加反应导致c(H+)降低,pH增大;
②饱和的NH4Cl溶液继续加入NH4Cl固体,NH4Cl不溶解导致溶液中c(H+)不变,所以理论上不会影响溶液pH值;
③加入NH4HCO3,由于H2CO3的酸性比盐酸弱,所以其溶液中水解生成的碳酸酸性比盐酸弱,因此溶液的pH值就会比较高,往NH4Cl中加入它就会使pH值升高;
④加入大量的水后,促进NH4Cl水解,但NH4Cl水解增大程度小于溶液体积增大程度,所以溶液中c(H+)降低,pH增大;
⑤氯水是酸性的,且酸性大于NH4Cl溶液,加入后溶液中c(H+)增大,则溶液的pH值会下降;
⑥Cu不与NH4Cl反应,所以不影响NH4Cl水解,溶液中c(H+)不变,则pH值理论上没影响,
所以能使该溶液的pH增大的是Mg、NH4HCO3、H2O,
能使该溶液的pH值增大的是:Mg、NH4HCO3、H2O.
故选D.
点评 本题考查水解平衡原理,明确加入物质对c(H+)的影响是解本题关键,注意加水稀释虽然促进氯化铵水解但溶液的pH增大,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列各组物质的性质顺序,不正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
15.在下列变化过程中,被破坏的作用力正确的是( )
| A. | 冰融化一一共价键 | B. | 氢氧化钠熔融--离子键、共价键 | ||
| C. | 氯化氢溶于水--范德华力 | D. | 硫酸氢钠溶于水--离子键、共价键 |
12.化学用语是化学学科中最美的语言,下列有关化学用语使用不正确的是( )
| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: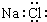 |
19.已知短周期元素的离子aB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 B>D>C | |
| B. | 原子序数 d>c>a | |
| C. | 离子半径 C>D>B | |
| D. | 原子结构的最外层电子数目 B>D>C |
9.下列金属中,按照金属性从弱到强的顺序排列的是( )
| A. | 铝、镁、钠、钾 | B. | 镁、铝、钾、钠 | C. | 钙、钾、铷、钠 | D. | 钙、钾、钠、锂 |
13.化合物的“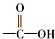 ”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
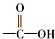 ”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )| A. | CHBr=CHCH3 | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
 .
.