题目内容
14.下列各组物质的性质顺序,不正确的是( )| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
分析 A.位于同周期,原子序数大的原子半径小;
B.非金属性越强,对应气态氢化物越稳定;
C.硫酸与碳酸钠反应生成碳酸、碳酸与硅酸钠反应生成硅酸;
D.二氧化硅为原子晶体,NaCl为离子晶体,二氧化碳为分子晶体.
解答 解:A.Na、Mg、Al均为第三周期元素,原子序数依次增大,则原子半径为Na>Mg>Al,故A错误;
B.由同族元素的性质可知,非金属性为Cl>Br>I,则气态氢化物稳定性为HCl>HBr>HI,故B正确;
C.由强酸制取弱酸的反应原理可知,硫酸与碳酸钠反应生成碳酸、碳酸与硅酸钠反应生成硅酸,则酸性为H2SiO3<H2CO3<H2SO4,故C正确;
D.二氧化硅为原子晶体,NaCl为离子晶体,二氧化碳为分子晶体,一般来说,熔点为原子晶体>离子晶体>分子晶体,则熔点为SiO2>NaCl>CO2,故D正确;
故选A.
点评 本题考查物质及微粒性质的比较,为高频考点,把握同周期、同主族元素的性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大,选项C为解答的易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.某溶液中大量存在Ba2+、H+、Cl-,该溶液中还可能大量存在的离子是( )
| A. | Ag+ | B. | SO42- | C. | CH3COO- | D. | Mg2+ |
5.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的工艺流程如下:
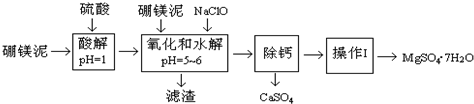
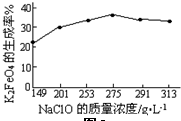
已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸来配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是A.
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤蒸发浓缩、趁热过滤.
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O196.8g,则MgSO4•7H2O的产率为80.0%(相对分子质量:MgSO4•7H2O-246 MgO-40).

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸来配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是A.
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4•7H2O196.8g,则MgSO4•7H2O的产率为80.0%(相对分子质量:MgSO4•7H2O-246 MgO-40).
2.邻苯二甲酸酯类是最常见的塑化剂,实验室制备邻苯二甲酸二丁酯的反应原理如下,其中n-C4H9OH表示正丁醇.

已知:(1)上述反应的第一步进行得迅速而完全,第二步反应可逆,较难进行.
(2)有关物质的性质如下表所示:
实验步骤:装置图如1图所示,夹持装置、加热装置均略去.
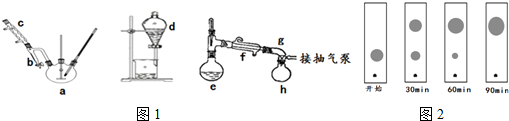
(Ⅰ)制备粗产品:在三颈烧瓶侧口插入温度计,另一侧口连接分水器与冷凝管,从中间口先加入3g(0.02mol)邻苯二甲酸酐及几粒沸石,在振摇下缓慢加入6.5mL(0.07mol)正丁醇和0.1mL浓硫酸的混合液.安装搅拌装置.在分水器中加入正丁醇至支管平齐.缓慢升温,使混合物微沸,至瓶内固体完全消失.继续回流,分水器中有小液滴沉入底部,当温度升到140℃时便可停止加热.
(Ⅱ)粗产品纯化:当反应液冷却到70℃以下时,将混合液转入分液漏斗,加入10mL 5% Na2CO3溶液洗涤,有机层用15mL温热的饱和食盐水洗涤2~3次,至有机层呈中性,分离出的油状物,用无水硫酸镁干燥,除去干燥剂.有机层先蒸去过量的正丁醇,最后在抽气泵的减压下蒸馏,收集180~190℃的馏分即得产品,称量质量.回答下列问题:
(1)仪器e的名称蒸馏烧瓶,浓硫酸的作用是催化剂,吸水剂抽气泵的作用是可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度.
(2)制备装置中冷凝水的流向与冷凝管中蒸汽的流向相同,制备过程中反应进行到终点的标志是分水器中的水位不再发生变化.
(3)产品纯化过程中,加入Na2CO3溶液的目的是将硫酸和 转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.
转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.
(4)实验中还可采用薄层色谱法(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始后的不同时间,用毛细管从三颈烧瓶中取样、点样、薄层色谱展开后在紫外灯照射下(含苯环结构的物质可显色)斑点如图2.你认为不可能出现的情况是D.
A.开始 B.30min C.60min D.90min.

已知:(1)上述反应的第一步进行得迅速而完全,第二步反应可逆,较难进行.
(2)有关物质的性质如下表所示:
| 物质 | 性质(沸点及分解温度均为101kPa测得) |
| 邻苯二甲酸酐 (M=148g/mol) | 白色针状晶体.不溶于冷水,溶于热水及有机溶剂. 密度1.53g/cm3,沸点295℃. |
| 正丁醇(M=74g/mol) | 无色液体.微溶于水,溶于有机溶剂.密度0.81g/cm3,沸点117.7℃.可与水形成二元共沸物(沸点92.7℃). |
| 邻苯二甲酸二丁酯 (M=278g/mol) | 无色油状液体.难溶于水,溶于有机溶剂.密度1.49g/cm3,沸点340℃.酸性条件下180℃以上易发生分解. |

(Ⅰ)制备粗产品:在三颈烧瓶侧口插入温度计,另一侧口连接分水器与冷凝管,从中间口先加入3g(0.02mol)邻苯二甲酸酐及几粒沸石,在振摇下缓慢加入6.5mL(0.07mol)正丁醇和0.1mL浓硫酸的混合液.安装搅拌装置.在分水器中加入正丁醇至支管平齐.缓慢升温,使混合物微沸,至瓶内固体完全消失.继续回流,分水器中有小液滴沉入底部,当温度升到140℃时便可停止加热.
(Ⅱ)粗产品纯化:当反应液冷却到70℃以下时,将混合液转入分液漏斗,加入10mL 5% Na2CO3溶液洗涤,有机层用15mL温热的饱和食盐水洗涤2~3次,至有机层呈中性,分离出的油状物,用无水硫酸镁干燥,除去干燥剂.有机层先蒸去过量的正丁醇,最后在抽气泵的减压下蒸馏,收集180~190℃的馏分即得产品,称量质量.回答下列问题:
(1)仪器e的名称蒸馏烧瓶,浓硫酸的作用是催化剂,吸水剂抽气泵的作用是可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度.
(2)制备装置中冷凝水的流向与冷凝管中蒸汽的流向相同,制备过程中反应进行到终点的标志是分水器中的水位不再发生变化.
(3)产品纯化过程中,加入Na2CO3溶液的目的是将硫酸和
 转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.
转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.(4)实验中还可采用薄层色谱法(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始后的不同时间,用毛细管从三颈烧瓶中取样、点样、薄层色谱展开后在紫外灯照射下(含苯环结构的物质可显色)斑点如图2.你认为不可能出现的情况是D.
A.开始 B.30min C.60min D.90min.
9.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1:

回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲阳离子是Fe2+.
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol•L-1,当溶液的pH等于10时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O═H2TiO3↓+2H+.
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式TiO2+4e-═Ti+2O2-.

回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲阳离子是Fe2+.
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O═H2TiO3↓+2H+.
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式TiO2+4e-═Ti+2O2-.
3.下列有关金属元素的叙述中正确的是( )
| A. | 某金属元素从化合态变为游离态时,该元素一定发生还原反应 | |
| B. | 含金属元素的离子,一定都是阳离子 | |
| C. | 金属阳离子被还原一定得到金属单质 | |
| D. | 在氧化还原反应中,金属单质一定被还原 |
4.在NH4Cl饱和溶液中分别加入①Mg;②NH4Cl(固);③NH4HCO3;④H2O;⑤氯水;⑥Cu.能使该溶液的pH值增大的是( )
| A. | ②③ | B. | ①②⑤ | C. | ②③⑥ | D. | ①③④ |

 ;
;