��Ŀ����
16����֪1mol CO������ȫȼ������CO2���壬�ų�283KJ������1mol������ȫȼ������Һ̬ˮ�ų�286KJ������1mol CH4������ȫȼ������CO2�����Һ̬ˮ�ų�890KJ������1��д��H2ȼ���ȵ��Ȼ�ѧ����ʽH2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-286kJ•mol-1
��2����1mol CH4������ȫȼ������CO2�����ˮ�������ų�������890KJ���=������������������
��3������a mol CH4��CO��H2���������ȫȼ�գ�����CO2�����ˮ��������ų�������Q����ȡֵ��Χ��283a kJ��Q��890akJ
��4������a mol CH4��CO��H2���������ȫȼ�գ�����CO2�����ˮ��������CO2��H2O���ʵ�����ȣ���ų�������Q����ȡֵ��Χ��284.5a kJ��Q��586.5a kJ��
��5����Cl2����ijЩ�����л���ʱ�����������HC1�����÷�ӦA����ʵ���ȵ�ѭ�����ã���ӦA��
4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400��}$ 2Cl2+2H2O
��֪����ӦA�У�4mol HCl���������ų�115.6kJ��������
��
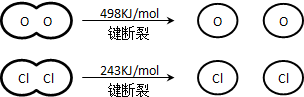
��H2O�ĵ���ʽ��
 ��
���ڷ�ӦA���Ȼ�ѧ����ʽ��4HCl��g��+O2��g��?2Cl2��g��+2H2O��g����H=-115.6 KJ/mol����
�۶Ͽ�1mol H-O ����Ͽ� 1mol H-Cl �������������ԼΪ32KJ��H2O��H-O �� ��HCl��H-Cl�����ǿ����������ǿ��
�ܶ��ڷ�ӦA��ͼ��4��Ͷ�ϱ�[n��HCl����n��O2�����ֱ�Ϊ1��1��2��1��4��1��6��1��]�£���Ӧ�¶ȶ�HClƽ��ת����Ӱ������ߣ�
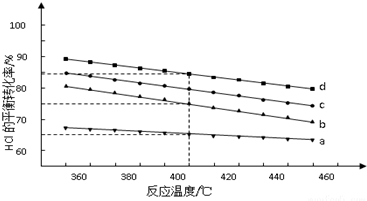
������b��Ӧ��Ͷ�ϱ���4��1��
��Ͷ�ϱ�Ϊ2��1���¶�Ϊ400��ʱ��ƽ��������Cl2�����ʵ���������30.8%��
��6�����ʣ�t-BuNO��2���������ܼ��з������·�Ӧ����t-BuNO��2?2��t-BuNO����
ʵ���ø÷�Ӧ�ġ�H=+50.5kJ•mol-1�����Ea=90.4kJ•mol-1������������ϵͼ��������D��

�÷�Ӧ�ġ�S��0�����������������=�������ڽϸߣ���ϸߡ��ϵ͡����¶��������ڸ÷�Ӧ�Է����У�
���� ��1������1mol������ȫȼ������Һ̬ˮ�ų�286KJ����д���Ȼ�ѧ����ʽ����ע���ʾۼ�״̬�Ͷ�Ӧ�ʱ䣻
��2�����ݲ�ͬ�ۼ�״̬��ˮ��������ͬ�������ж�1molCH4������ȫȼ������CO2�����ˮ�����ų���������
��3�����ü������㣻
��4��CO2�����ˮ�����ʵ�����ȣ��������۷����㣮
��5���ٹ��ۻ�����ĵ���ʽ�ɶ�Ӧԭ�ӵĵ���ʽ��ɣ���Ҫ��ʾ����ԭ��֮��Ĺ��õ��Ӷ������
�ڷ�ӦA�У�4mol HCl���������ų�115.6kJ�������������Ȼ�ѧ����ʽ��д��������ע���ʾۼ�״̬�Ͷ�Ӧ�ʱ�д����
�۷�Ӧ�ȡ�H=��Ӧ���ܼ���-��������ܼ��ܣ��ݴ˼���H-O����H-Cl���ļ��ܲ��������Ͽ�1mol H-O����Ͽ�1mol H-Cl�����������
�ܢ���������������ʱ��O2����Խ��HCl��ת����Խ��
�����ݻ�ѧƽ������ʽ��ʽ����õ���
��6����ʵ���ø÷�Ӧ�ġ�H=+50.5 kJ•mol-1����֪�÷�Ӧ�����ȷ�Ӧ����Ӧ���������������������������������ݻ��Ea=90.4 kJ•mol-1��Ea-��H��50.5kJ•mol-1��
���ڸ÷�Ӧ��һ���ֽⷴӦ��������һ�����Ҷ����ӣ��������ķ�Ӧ����S��0�����÷�Ӧ����һ�����ȷ�Ӧ����H��0����ϡ�G=��H-T��S�жϣ�
��� �⣺��1��1molH2��O2����ȫȼ�գ�����1molҺ̬ˮ���ų�286kJ��������ʾH2ȼ���ȵĻ�ѧ����ʽΪ��H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-286kJ•mol-1��
�ʴ�Ϊ��H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-286kJ•mol-1��
��2��ˮ����̬��ΪҺ̬ʱҪ�ų�����������1mol CH4������ȫȼ������CO2�����Һ̬ˮ�ų�890KJ��������1mol CH4������ȫȼ������CO2�����ˮ�������ų�������С��890kJ��
�ʴ�Ϊ������
��3��amolȫ����CO���ų�����Ϊ283a kJ��
ͬ����amolȫ����CH4���ų�����Ϊ890a kJ��amolȫ����H2���ų�����Ϊ286a kJ��
�ʽ���amol CH4��CO��H2�Ļ��������ȫȼ�����������Һ̬ˮ���ų�����Q��ȡֵ��Χ�ǣ�283a kJ��Q��890akJ��
�ʴ�Ϊ��283a kJ��Q��890akJ��
��4�����ɵ�CO2��Һ̬H2O�����ʵ�����ȣ����ü�������������¼��ֿ���
������CO�����ɵ�CO2��Һ̬H2O�����ʵ�������ȣ��ʲ�������
������H2��������CO��CH4��Ϊ$\frac{a}{2}$mol��
�ų���������Q��=$\frac{a}{2}$����283+890��=586.5a kJ��
������CH4��������CO��H2��Ϊ$\frac{a}{2}$mol��
�ų���������Q��=$\frac{a}{2}$����283+286��=284.5a kJ��
������������������ܣ�
���Էų���������Q����ȡֵ��ΧΪ��284.5a kJ��Q��586.5a kJ
�ʴ�Ϊ��284.5a kJ��Q��586.5a kJ��
��5����H2O�ǹ��ۻ��������ԭ�Ӻ���ԭ���γɹ��ۼ�������ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
�����ݷ�ӦA�У�4mol HCl���������ų�115.6kJ����������Ӧ���Ȼ�ѧ����ʽΪ��4HCl��g��+O2��g��?2Cl2��g��+2H2O��g����H=-115.6 KJ/mol��
�ʴ�Ϊ��4HCl��g��+O2��g��?2Cl2��g��+2H2O��g����H=-115.6 KJ/mol��
��E��H-O����E��HCl���ֱ��ʾH-O���ܡ�H-Cl���ܣ���ӦA�У�4mol HCl���������ų�115.6kJ����������Ӧ�ȡ�H=��Ӧ���ܼ���-��������ܼ��ܣ��ʣ�4��E��H-Cl��+498kJ/mol-[2��243kJ/mol+4��E��H-O��]=-115.6kJ/mol�������ã�4E��H-Cl��-4E��H-O��=-127.6kJ/mol����E��H-O��-E��HCl��=31.9kJ/mol��
�ʶϿ�1mol H-O����Ͽ�1mol H-Cl�������������ԼΪ31.9kJ/mol��1mol=31.9kJ��32kJ������H2O��H-O ����HCl��H-Cl��ǿ��
�ʴ�Ϊ��32��ǿ��
�ܢ���������������ʱ��O2����Խ��HCl��ת����Խ���ɴ˿�ȷ��aΪ6��1��bΪ4��1��cΪ2��1��dΪ1��1���ʴ�Ϊ��4��1��
����ͼ�ɶ���Ͷ�ϱ�Ϊ2��1���¶�Ϊ400��ʱ��HCl��ת����Ϊ80%����Ͷ���HClΪ2 mol��O2Ϊ1 mol���ɴ˿ɽ�������ʽ��
4HCl+O2=2Cl2+2H2O
n����ʼ��/mol 2 1 0 0
n��ת����/mol 1.6 0.4 0.8 0.8
n��ƽ�㣩/mol 0.4 0.6 0.8 0.8
����ƽ��������Cl2�����ʵ�������=$\frac{0.8mol}{0.4mol+0.6mol+0.8mol+0.8mol}$��100%=30.8%��
�ʴ�Ϊ��30.8%��
��6����ʵ���ø÷�Ӧ�ġ�H=+50.5 kJ•mol-1����֪�÷�Ӧ�����ȷ�Ӧ����Ӧ�������������������������������ų�������ϵͼB��C�������ݻ��Ea=90.4 kJ•mol-1��Ea-��H��50.5kJ•mol-1��������ϵͼA��Ea-��H��50.5 kJ•mol-1��Ea���H�ı������ԣ���������ϵͼD�Ǻ����ģ����ڸ÷�Ӧ��һ���ֽⷴӦ��������һ�����Ҷ����ӣ��������ķ�Ӧ����S��0�����÷�Ӧ����һ�����ȷ�Ӧ������H��0���ɡ�G=��H-T��S��֪�����Ը÷�Ӧ�ڽϸ��¶����������Է����У�
�ʴ�Ϊ��D�������ϸߣ�
���� �����ǵ��ۺ��⣬�漰�Ȼ�ѧ����ʽ���Ȼ�ѧ����ʽ��д����ѧ�����ܺ��ʱ��ϵ���㣬ͼ������жϡ���ѧ��Ӧת���ʼ��㣬��Ŀ�Ѷ��еȣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | 3.2gͭ������ϡ���ᷴӦ������ת�Ƶ���0.1NA | |
| B�� | 35.5g�������أ�KO2�������������ӵ���ĿΪNA | |
| C�� | ��״���½�0.5molSO2������0.5molH2S�����Ϻ�����ķ�������ΪNA | |
| D�� | 6g���������к�Si-O����Ϊ0.2NA |
| A�� | �ڢ� | B�� | �٢ڢ� | C�� | �ڢۢ� | D�� | �٢ۢ� |
| A�� | ��������NaOHˮ��Һ��ϼ��Ⱥ���ȴ��������������Һ�е���ɫ���� | |
| B�� | ����������������ˮ��õ������ǣ��ټ�������������Һ��ˮԡ���ȣ��ɵ����� | |
| C�� | ������������ȥ�����е���ϩ���ɽ���Ӧ�ݳ�������ֱ��ͨ������KMnO4��Һ�� | |
| D�� | ͨ���˴Ź������ķ��������Լ������������NaOHˮ��Һ��ˮ��IJ������Ҵ����� |
 ���������һ�������ǻ���������������������������Ŀǰ����Ҫ��һ��������ͼ�DZ���ͳ�Ƶ�������������Դ�ͳɷַ��������ж�����������������ʩ��������ȷ���ǣ�������
���������һ�������ǻ���������������������������Ŀǰ����Ҫ��һ��������ͼ�DZ���ͳ�Ƶ�������������Դ�ͳɷַ��������ж�����������������ʩ��������ȷ���ǣ�������| A�� | ��ֵ�ϴ��ȼú����ȥȼú����Ļҳ� | |
| B�� | �ӿ��ҹ��ɡ�ȼú��ʱ�����뵽��������ʱ���IJ��� | |
| C�� | ���ô�ת������������β���е�NO2��COת��Ϊ������ | |
| D�� | ����NO2��һ�ַ��������ü������ԭNO2����CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g������H=-512kJ•mol-1����1g���鴦��NO2��Ҫ�ų�16kJ������ |
| A�� | 86 | B�� | 136 | C�� | 50 | D�� | 222 |
 ������ӿ�����ζ���������������������ߵĽṹ��ʽ��ͼ��ʾ������˵������ȷ���ǣ�������
������ӿ�����ζ���������������������ߵĽṹ��ʽ��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | ���ķ���ʽΪC13H10O3 | |
| B�� | ������Ӻ����������Ȼ�����Һ������ɫ��Ӧ | |
| C�� | ���������Ũ��ˮֻ����ȡ����Ӧ | |
| D�� | ���Ͷ�����Ӿ��ܷ���������Ӧ |
| A�� | ���ʯ��ʯī | B�� | mnX��wnX | ||
| C�� | ��������ͬ����������ͬ���� | D�� | 11H��21H |