题目内容
12.化学用语是化学学科中最美的语言,下列有关化学用语使用不正确的是( )| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: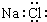 |
分析 A.钙为金属元素,元素符号为Ca;
B.硫离子的核外电子总数为18,最外层达到8电子稳定结构;
C.二氧化碳分子中含有两个碳氧双键,为直线型结构;
D.氯化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷.
解答 解:A.钙为20号元素,其元素符号为:Ca,故A正确;
B.硫离子的核电荷数为16,核外电子总数为18,其离子结构示意图为: ,故B正确;
,故B正确;
C.用短线代替所有共价键即为结构式,二氧化碳分子中含有两个碳氧双键,其结构式为:O=C=O,故C正确;
D.氯化钠中含有钠离子和氯离子,钠离子直接用离子符号表示,氯离子需要标出所带电荷及最外层电子,氯化钠正确的电子式为: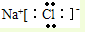 ,故D错误;
,故D错误;
故选D.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握元素符号、离子结构示意图、电子式、结构式的概念及书写原则,明确离子化合物与共价化合物的电子式的区别,试题侧重考查学生的规范答题能力.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
2.邻苯二甲酸酯类是最常见的塑化剂,实验室制备邻苯二甲酸二丁酯的反应原理如下,其中n-C4H9OH表示正丁醇.

已知:(1)上述反应的第一步进行得迅速而完全,第二步反应可逆,较难进行.
(2)有关物质的性质如下表所示:
实验步骤:装置图如1图所示,夹持装置、加热装置均略去.
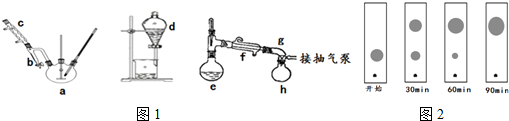
(Ⅰ)制备粗产品:在三颈烧瓶侧口插入温度计,另一侧口连接分水器与冷凝管,从中间口先加入3g(0.02mol)邻苯二甲酸酐及几粒沸石,在振摇下缓慢加入6.5mL(0.07mol)正丁醇和0.1mL浓硫酸的混合液.安装搅拌装置.在分水器中加入正丁醇至支管平齐.缓慢升温,使混合物微沸,至瓶内固体完全消失.继续回流,分水器中有小液滴沉入底部,当温度升到140℃时便可停止加热.
(Ⅱ)粗产品纯化:当反应液冷却到70℃以下时,将混合液转入分液漏斗,加入10mL 5% Na2CO3溶液洗涤,有机层用15mL温热的饱和食盐水洗涤2~3次,至有机层呈中性,分离出的油状物,用无水硫酸镁干燥,除去干燥剂.有机层先蒸去过量的正丁醇,最后在抽气泵的减压下蒸馏,收集180~190℃的馏分即得产品,称量质量.回答下列问题:
(1)仪器e的名称蒸馏烧瓶,浓硫酸的作用是催化剂,吸水剂抽气泵的作用是可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度.
(2)制备装置中冷凝水的流向与冷凝管中蒸汽的流向相同,制备过程中反应进行到终点的标志是分水器中的水位不再发生变化.
(3)产品纯化过程中,加入Na2CO3溶液的目的是将硫酸和 转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.
转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.
(4)实验中还可采用薄层色谱法(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始后的不同时间,用毛细管从三颈烧瓶中取样、点样、薄层色谱展开后在紫外灯照射下(含苯环结构的物质可显色)斑点如图2.你认为不可能出现的情况是D.
A.开始 B.30min C.60min D.90min.

已知:(1)上述反应的第一步进行得迅速而完全,第二步反应可逆,较难进行.
(2)有关物质的性质如下表所示:
| 物质 | 性质(沸点及分解温度均为101kPa测得) |
| 邻苯二甲酸酐 (M=148g/mol) | 白色针状晶体.不溶于冷水,溶于热水及有机溶剂. 密度1.53g/cm3,沸点295℃. |
| 正丁醇(M=74g/mol) | 无色液体.微溶于水,溶于有机溶剂.密度0.81g/cm3,沸点117.7℃.可与水形成二元共沸物(沸点92.7℃). |
| 邻苯二甲酸二丁酯 (M=278g/mol) | 无色油状液体.难溶于水,溶于有机溶剂.密度1.49g/cm3,沸点340℃.酸性条件下180℃以上易发生分解. |

(Ⅰ)制备粗产品:在三颈烧瓶侧口插入温度计,另一侧口连接分水器与冷凝管,从中间口先加入3g(0.02mol)邻苯二甲酸酐及几粒沸石,在振摇下缓慢加入6.5mL(0.07mol)正丁醇和0.1mL浓硫酸的混合液.安装搅拌装置.在分水器中加入正丁醇至支管平齐.缓慢升温,使混合物微沸,至瓶内固体完全消失.继续回流,分水器中有小液滴沉入底部,当温度升到140℃时便可停止加热.
(Ⅱ)粗产品纯化:当反应液冷却到70℃以下时,将混合液转入分液漏斗,加入10mL 5% Na2CO3溶液洗涤,有机层用15mL温热的饱和食盐水洗涤2~3次,至有机层呈中性,分离出的油状物,用无水硫酸镁干燥,除去干燥剂.有机层先蒸去过量的正丁醇,最后在抽气泵的减压下蒸馏,收集180~190℃的馏分即得产品,称量质量.回答下列问题:
(1)仪器e的名称蒸馏烧瓶,浓硫酸的作用是催化剂,吸水剂抽气泵的作用是可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度.
(2)制备装置中冷凝水的流向与冷凝管中蒸汽的流向相同,制备过程中反应进行到终点的标志是分水器中的水位不再发生变化.
(3)产品纯化过程中,加入Na2CO3溶液的目的是将硫酸和
 转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.
转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.(4)实验中还可采用薄层色谱法(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始后的不同时间,用毛细管从三颈烧瓶中取样、点样、薄层色谱展开后在紫外灯照射下(含苯环结构的物质可显色)斑点如图2.你认为不可能出现的情况是D.
A.开始 B.30min C.60min D.90min.
3.下列有关金属元素的叙述中正确的是( )
| A. | 某金属元素从化合态变为游离态时,该元素一定发生还原反应 | |
| B. | 含金属元素的离子,一定都是阳离子 | |
| C. | 金属阳离子被还原一定得到金属单质 | |
| D. | 在氧化还原反应中,金属单质一定被还原 |
20.某同学按图所示的装置进行电解实验.下列说法正确的是( )
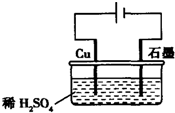

| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断增大 |
7.下列关于阿伏加德罗常数(NA),的说法正确的是( )
| A. | 3.2g铜与足量稀硝酸反应过程中转移电子0.1NA | |
| B. | 35.5g超氧化钾(KO2)所含的阴离子的数目为NA | |
| C. | 标准状况下将0.5molSO2气体与0.5molH2S气体混合后,气体的分子总数为NA | |
| D. | 6g二氧化硅中含Si-O键数为0.2NA |
17.下列叙述都涉及化学相关知识,其中正确的是( )
| A. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | |
| B. | 10 g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| C. | 200 ml1mol/LFe2(SO4 )3溶液中,Fe3+和SO42-离子数的总和是NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |
4.在NH4Cl饱和溶液中分别加入①Mg;②NH4Cl(固);③NH4HCO3;④H2O;⑤氯水;⑥Cu.能使该溶液的pH值增大的是( )
| A. | ②③ | B. | ①②⑤ | C. | ②③⑥ | D. | ①③④ |
1. 今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )
今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )
 今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )
今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )| A. | 充分的洗涤燃煤,除去燃煤表面的灰尘 | |
| B. | 加快我国由“燃煤”时代进入到“油气”时代的步伐 | |
| C. | 采用催化转换技术将汽车尾气中的NO2和CO转化为无毒气体 | |
| D. | 处理NO2的一种方法是利用甲烷催化还原NO2,若CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-512kJ•mol-1,则1g甲烷处理NO2需要放出16kJ的热量 |
2.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊.再升高至65℃以上,溶液变澄清. | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. | Na2AlO2溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |