题目内容
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH(C6H5OH相当于一元弱酸):
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O。若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______________(填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa―→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa―→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH―→NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol·L-1的下列六种物质的溶液中,pH最小的是________(填编号);其pH等于________(填数值);pH最大的是________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO
⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体根据上述反应,总结出复分解反应发生的另一规律___________________________________________
将KI溶液和AgCl固体混合搅拌,会观察到的现象是____________________________________,请写出反应的离子方程式______________________________________________
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH(C6H5OH相当于一元弱酸):
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O。若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______________(填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa―→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa―→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH―→NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol·L-1的下列六种物质的溶液中,pH最小的是________(填编号);其pH等于________(填数值);pH最大的是________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO
⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体根据上述反应,总结出复分解反应发生的另一规律___________________________________________
将KI溶液和AgCl固体混合搅拌,会观察到的现象是____________________________________,请写出反应的离子方程式______________________________________________
(1)A、D
(2)⑤ 1 ①
(3)复分解反应能够向生成更难溶(或溶解度更小)物质的方向进行 白色固体变成黄色
I-(aq)+AgCl(s)=AgI(s)+Cl-(aq)
(2)⑤ 1 ①
(3)复分解反应能够向生成更难溶(或溶解度更小)物质的方向进行 白色固体变成黄色
I-(aq)+AgCl(s)=AgI(s)+Cl-(aq)
(1)分析碱性强弱。A项,Na2CO3>NaClO;B项,NaClO>NaHCO3;C项,C6H5ONa>NaHCO3;D项,Na2CO3>C6H5ONa;E项,Na2CO3>NaHCO3;F项,NaCN>CH3COONa。据题意可知A、D项不能成立。
(2)根据水解规律可知,弱酸强碱盐的碱性越强对应弱酸的酸性越弱,pH越大;另外对强酸,非金属性越强,最高价含氧酸的酸性越强,pH越小,但H2SO4是二元酸,浓度相同时,H+浓度是HClO4的2倍,所以pH最小的是H2SO4,经计算可知pH=1,pH最大的是C6H5OH。
(3)①石灰乳与纯碱反应生成CaCO3沉淀和NaOH,CaCO3比Ca(OH)2溶解度小。
②NaHCO3溶解度小于NH4HCO3和NaCl,故两种饱和溶液混合生成溶解度小的NaHCO3。
③NaCl溶解度比NaNO3、KCl小。
AgI比AgCl溶解度小。
综合上述规律可知复分解反应能够向生成更难溶(或溶解度更小)物质的方向进行。
(2)根据水解规律可知,弱酸强碱盐的碱性越强对应弱酸的酸性越弱,pH越大;另外对强酸,非金属性越强,最高价含氧酸的酸性越强,pH越小,但H2SO4是二元酸,浓度相同时,H+浓度是HClO4的2倍,所以pH最小的是H2SO4,经计算可知pH=1,pH最大的是C6H5OH。
(3)①石灰乳与纯碱反应生成CaCO3沉淀和NaOH,CaCO3比Ca(OH)2溶解度小。
②NaHCO3溶解度小于NH4HCO3和NaCl,故两种饱和溶液混合生成溶解度小的NaHCO3。
③NaCl溶解度比NaNO3、KCl小。
AgI比AgCl溶解度小。
综合上述规律可知复分解反应能够向生成更难溶(或溶解度更小)物质的方向进行。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 )+c(H2CO3)
)+c(H2CO3) )+c(
)+c(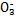 )>c(S
)>c(S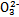 )>c(OH-)
)>c(OH-)