题目内容
向10 mL 0.1 mol·L-1Na2CO3溶液中逐滴滴加V mL 0.1 mol·L-1HCl溶液,下列有关滴定过程中粒子浓度关系正确的是
A.当V=0时,c(OH-)=c(H+)+c( )+c(H2CO3) )+c(H2CO3) |
B.当V=5时,c(Na+)+c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
C.当V=10时,c(Cl-)=c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
D.当V=15时,c(Na+)=c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
C
在碳酸钠溶液中存在碳酸钠的水解和水的电离,由质子守恒可得:c(OH-)=c(H+)+c( )+2c(H2CO3),A错误;当V=5时溶液中的溶质是碳酸钠、碳酸氢钠和氯化钠,由物质电中性原则可得:c(H+)+c(Na+)=c(OH-)+c(
)+2c(H2CO3),A错误;当V=5时溶液中的溶质是碳酸钠、碳酸氢钠和氯化钠,由物质电中性原则可得:c(H+)+c(Na+)=c(OH-)+c( )+2c(
)+2c( )+c(Cl-),B错误;当V=10时,反应后的溶液中溶质为等物质的量的氯化钠,碳酸氢钠,由质量守恒和有关物质的物质的量关系可得:c(Cl-)=c(H2CO3)+c(
)+c(Cl-),B错误;当V=10时,反应后的溶液中溶质为等物质的量的氯化钠,碳酸氢钠,由质量守恒和有关物质的物质的量关系可得:c(Cl-)=c(H2CO3)+c( )+c(
)+c( ),C正确;当V=15时,溶液中溶质为氯化钠、碳酸氢钠,而且二者的物质的量之比为3∶1,溶液c(Na+)>c(Cl-),D错误。
),C正确;当V=15时,溶液中溶质为氯化钠、碳酸氢钠,而且二者的物质的量之比为3∶1,溶液c(Na+)>c(Cl-),D错误。
 )+2c(H2CO3),A错误;当V=5时溶液中的溶质是碳酸钠、碳酸氢钠和氯化钠,由物质电中性原则可得:c(H+)+c(Na+)=c(OH-)+c(
)+2c(H2CO3),A错误;当V=5时溶液中的溶质是碳酸钠、碳酸氢钠和氯化钠,由物质电中性原则可得:c(H+)+c(Na+)=c(OH-)+c( )+2c(
)+2c( )+c(Cl-),B错误;当V=10时,反应后的溶液中溶质为等物质的量的氯化钠,碳酸氢钠,由质量守恒和有关物质的物质的量关系可得:c(Cl-)=c(H2CO3)+c(
)+c(Cl-),B错误;当V=10时,反应后的溶液中溶质为等物质的量的氯化钠,碳酸氢钠,由质量守恒和有关物质的物质的量关系可得:c(Cl-)=c(H2CO3)+c( )+c(
)+c( ),C正确;当V=15时,溶液中溶质为氯化钠、碳酸氢钠,而且二者的物质的量之比为3∶1,溶液c(Na+)>c(Cl-),D错误。
),C正确;当V=15时,溶液中溶质为氯化钠、碳酸氢钠,而且二者的物质的量之比为3∶1,溶液c(Na+)>c(Cl-),D错误。
练习册系列答案
相关题目
 H2CO3
H2CO3 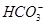 )>c(H+)
)>c(H+) H3O++ Y2-
H3O++ Y2-