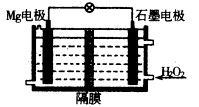
题目内容
将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,下列关系式正确的是( )
| A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(NH4+)<c(Cl-)<c(H+)<c(OH-) | D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
D
试题分析:盐酸是强酸。pH=2,则c(HCl)=c(H+)=10-2mol/L; 氨水是弱碱pH=12,则c(NH3·H2O)> c(OH-)=10-2mol/L.当二者等体积混合时,由于n(NH3·H2O)>n(HCl)。所以溶液为NH3·H2O和NH4Cl的混合溶液。由于NH3·H2O的电离作用大于NH4+的水解作用。所以c(NH4+)>c(Cl-);c(OH-)>c(H+);盐NH4Cl是强电解质。其电离作用大于弱电解质NH3·H2O的电离作用,所以c(Cl-)>c(OH-)。所以溶液中离子浓度的大小关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+)。选项为D。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
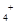 )>c(Cl
)>c(Cl )>c(Na
)>c(Na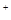 )>c(OH
)>c(OH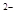 )+ c(HS
)+ c(HS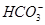 )>c(H+)
)>c(H+)