题目内容
将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合后,溶液pH>7,以下关系式错误的是A.c(A-)> c(HA) B.c(Na+)+c(H+)= c(A-)+c(Cl-)+c(OH-)
C.c(HA)+c(A-)=0.1mol/L D.c(Na+)= c(A-)+ c(HA)
C.c(HA)+c(A-)=0.1mol/L D.c(Na+)= c(A-)+ c(HA)
A
试题分析:将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合,发生反应:NaA+HCl=NaCl+HA。得到的是NaA、NaCl、HA等浓度等体积的混合溶液。由于此时溶液pH>7,说明NaA的水解作用大于HA的电离作用。所以c(A-)< c(HA)。A错误。根据电荷守恒可得c(Na+)+c(H+)= c(A-)+c(Cl-)+c(OH-)。正确。根据物料守恒可得c(HA)+c(A-)=0.1mol/L。正确。由于在物质NaA中n(Na+)=n(A-).A-在溶液中与酸发生反应变为HA。所以根据物料守恒及原子守恒可得c(Na+)= c(A-)+ c(HA)。正确。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
 )>c(Cl
)>c(Cl )>c(Na
)>c(Na )>c(OH
)>c(OH )+ c(HS
)+ c(HS H2CO3
H2CO3  的比值保持不变
的比值保持不变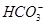 )>c(H+)
)>c(H+)