题目内容
2.某同学在实验报告中有以下的实验数据:①用托盘天平称取11.7g食盐
②用量筒量取5.26mL盐酸
③用广泛pH试纸测得溶液的pH是3.5
④用标准NaOH溶液滴定未知浓度的盐酸,用去23.10mL NaOH溶液.
其中数据合理的是( )
| A. | ①②③ | B. | ①③④ | C. | ①②③④ | D. | ①④ |
分析 ①托盘天平的准确度是0.1g;
②量筒量取液体体积最多到0.1mL;
③广泛pH试纸测得溶液pH为整数;
④滴定管测定或量取液体体积可以到0.01mL.
解答 解:①用托盘天平称取11.7g食盐符合天平的使用要求,故①正确;
②用量筒不能量取5.26mL的盐酸,因为量筒是一粗略量取液体体积的量具,最多量取到0.1mL,故②错误;
③广泛pH试纸是粗略测定溶液pH的一种实验用品,测得溶液的pH是整数,故③错误;
④滴定管是精密量具,能准确读取或量取液体体积,体积可精确到0.01mL,故④正确;
故选D.
点评 本题考查常见仪器的构造及使用方法、pH试纸的使用方法,题目难度不大,注意掌握常见仪器的使用方法,明确广泛pH试纸测得溶液pH是整数,为易错点.

练习册系列答案
相关题目
12.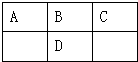 如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
 如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )| A. | H2CO3 | B. | H2SO4 | C. | HNO3 | D. | H3PO |
13.可逆反应2NO2$\frac{\underline{\;\;△\;\;}}{\;}$2NO+O2二氧化氮红棕色在密闭容器中反应,达到平衡状态的标志是( )
| A. | NO2、NO和O2三者共存 | |
| B. | 单位时间内生成n molO2的同时生成2n mol NO | |
| C. | 容器中颜色不再变化 | |
| D. | 容器中NO2、NO、O2的物质的量浓度之比为2:2:1的状态 |
10.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)+Q(Q>0),下列对图象的分析中不正确的是( )


| A. | 图Ⅰ研究的是t0时升高温度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 | |
| C. | 图Ⅲ研究的是压强对化学平衡的影响,且乙压强大于甲 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
7.如图为碱性氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
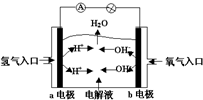

| A. | a电极是负极,电极反应为:H2-2e-═2H+ | |
| B. | b电极是正极,电极反应为:4OH-+4e-═2H2O+O2↑ | |
| C. | 电子从a极流向电流表、小灯泡、b极、通过电解质溶液形成闭合回路 | |
| D. | 电解质溶液中OH-向a极移动 |
14.下列有关物质检验的现象与结论均正确的是( )
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 向某工业废水中加入过量浓溴水 | 产生白色沉淀 | 该废水中可能含有苯酚 |
| B | 向溴乙烷中滴加硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 某有机物中加入金属Na | 产生气泡 | 该物质为乙醇 |
| D | 乙醇与浓硫酸共热,将产生的气体通入溴水中 | 溴水褪色 | 该气体一定为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
12.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 标准状况下,22.4L乙烷含共价键数目为7NA | |
| B. | 25℃时,1.0LpH=13的Ba(OH)2溶液含OH-数目为0.2NA | |
| C. | 铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA | |
| D. | 常温常压下,6gHe含中子数为2NA |
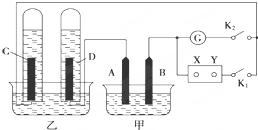 在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.
在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.