题目内容
17.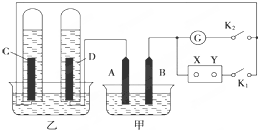 在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.
在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.请回答下列问题:
(1)B电极发生的电极反应为2H2O-4e-=O2↑+4H+;C电极发生的电极反应为2H++2e-=H2↑.
(2)甲装置电解时发生反应的离子方程式为Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+Cu↓+4H+.
(3)甲装置电解后溶液的c(H+)为0.8mol/L,要使电解后溶液恢复到电解前的状态,则需加入CuO或CuCO3(填化学式),其质量为8或12.4g.(假设电解前后溶液的体积不变)
分析 闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,说明A电极上析出Cu,则该电解质溶液中可溶性铜盐,B电极有无色气体生成,说明B电极上有氧气生成,则该可溶性铜盐为含氧酸盐;则X是正极、Y是负极,
(1)B电极上有无色气体生成,应该是氧气,则B电极上水失电子生成氧气和氢离子;C电极是阴极,C电极上氢离子放电生成氢气;
(2)甲装置中阳极上水失电子生成氧气和氢离子,阴极上铜离子放电生成铜;
(3)电解过程中溶液中c(H+)增大,根据铜和氢离子之间关系式计算c(H+);
要使电解质溶液恢复到原状,应该采用析出什么加入什么的方法.
解答 解:闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,说明A电极上析出Cu,则该电解质溶液中可溶性铜盐,B电极有无色气体生成,说明B电极上有氧气生成,则该可溶性铜盐为含氧酸盐;则X是正极、Y是负极,
(1)B电极上有无色气体生成,应该是氧气,则B电极上水失电子生成氧气和氢离子,则B电极反应式为2H2O-4e-=O2↑+4H+;C电极是阴极,C电极上氢离子放电生成氢气,电极反应式为 2H++2e-=H2↑,
故答案为:2H2O-4e-=O2↑+4H+; 2H++2e-=H2↑;
(2)甲装置中阳极上水失电子生成氧气和氢离子,阴极上铜离子放电生成铜,电池反应离子方程式为 Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+Cu↓+4H+,故答案为:Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+Cu↓+4H+;
(3)当溶液中的原有溶质完全电解后,停止电解,A电极增重6.4g,则n(Cu)=$\frac{6.4g}{64g/mol}$=0.1mol,根据Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+Cu↓+4H+知n(H+)=4n(Cu)=4×0.1mol=0.4mol,c(H+)=$\frac{0.4mol}{0.5L}$=0.8mol/L;
电解过程中,阳极上生成氧气、阴极上生成Cu,相当于析出CuO,根据析出什么加入什么原则,要使溶液恢复原状应该加入CuO或碳酸铜,根据Cu原子守恒得n(CuO)=n(CuCO3)=n(Cu)=0.1mol,m(CuO)=0.1mol×80g/mol=8g,m(CuCO3)=0.1mol×124g/mol=12.4g,
故答案为:0.8mol/L;Cu或CuCO3;8或12.4.
点评 本题考查电解原理,侧重考查学生分析计算能力,正确判断阴阳极及各个电极发生的反应是解本题关键,易错点是(3)题有关计算,注意加入碳酸铜也可以使溶液恢复原状.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | 小于1.8mol | B. | 等于0.9mol | C. | 等于1.8mol | D. | 大于1.8mol |
| A. | 盐酸是强酸,氢硫酸是弱酸 | B. | HClO4酸性比H2SO4强 | ||
| C. | 氯气与H2S能发生置换反应 | D. | 受热时,氯化氢比硫化氢稳定 |
| A. | 铜片质量减少 | B. | 石墨棒质量增加 | C. | 电流表指针偏转 | D. | 溶液显蓝色 |
| A. | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出,两份蛋白质均发生变性 | |
| B. | 只用溴水就可以将苯、四氯化碳、酒精、己烯、苯酚这五种物质区别开来 | |
| C. | 由于纤维素易发生水解反应,所以用纤维素织成的衣物不可在碱性溶液中洗涤 | |
| D. | 丙氨酸 分子中含有1个手性碳原子 分子中含有1个手性碳原子 |
①用托盘天平称取11.7g食盐
②用量筒量取5.26mL盐酸
③用广泛pH试纸测得溶液的pH是3.5
④用标准NaOH溶液滴定未知浓度的盐酸,用去23.10mL NaOH溶液.
其中数据合理的是( )
| A. | ①②③ | B. | ①③④ | C. | ①②③④ | D. | ①④ |
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
 ;B元素在周期表中的位置是第二周期ⅥA族.A比B的非金属性弱(填“强”或“弱”).
;B元素在周期表中的位置是第二周期ⅥA族.A比B的非金属性弱(填“强”或“弱”).