��Ŀ����
����Ŀ�������������ʹ�õĽ���֮һ��������ѧ֪ʶ���ش��������⡣
��1������Fe(OH)3�����FeCl3��Һ�ķ�����_______________��
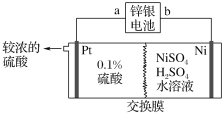
��2�����ӹ�ҵ��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�壬����˫���ű�ʾ������ת�Ƶķ������Ŀ_____________________
��3��ij�о���ѧϰС��Ϊ�ⶨFeCl3��ʴͭ��������Һ����ɣ�����������ʵ�飺
��ȡ����������Һ������KSCN��Һ�ʺ�ɫ����ɼ������Һ�к��еĽ�����������_____��
����֤����Һ�к���Fe2+����ȷ��ʵ�鷽����_______������ĸ�������
A���۲���Һ�Ƿ��dz��ɫ
B��ȡ������Һ���������Ը��������Һ������ɫ��֤������Fe2+
C��ȡ������Һ��������ˮ���ٵ���KSCN��Һ������Ѫ��ɫ��֤��ԭ��Һ�к���Fe2+
��4������ʦ��������ӡˢ��·��ķ�ˮ�л���ͭ�������FeCl3��Һ��������·�����
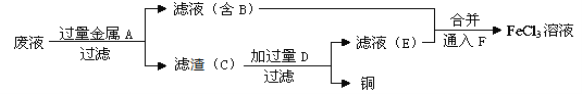
������C����Ҫ�ɷֵĻ�ѧʽΪ_______��_______��
�ڼӹ���D������Ӧ�����ӷ���ʽΪ__________________________________��
��ͨ��F������Ӧ�Ļ�ѧ����ʽΪ ___________________________________��
���𰸡���ƽ�й��������ַ�ɢϵ�����й�����ͨ·���ǽ��壬û������Һ��  Fe3+ B Fe Cu Fe+2H+=Fe2++H2�� 2FeCl2+Cl2===2FeCl3
Fe3+ B Fe Cu Fe+2H+=Fe2++H2�� 2FeCl2+Cl2===2FeCl3
��������
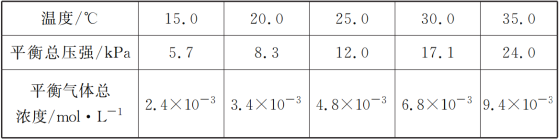
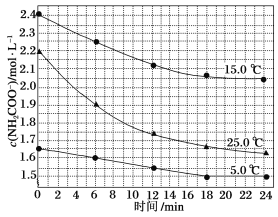
��1����������Һ���������Ƿ���ж����ЧӦ����
��2��ͭ���Ȼ�����Ӧ�����Ȼ�ͭ���Ȼ�������
��3����FeCl3��Һ��ͭ��Ӧ��2Fe3++Cu�T2Fe2++Cu2+�� ����KSCN��Һ�ʺ�ɫ���������������ӣ��ڳ���21.525g���Ȼ��������ʵ�����0.15mol���ۼ����Fe2+������
��4����ȡ�����Ȼ�����Һ������A��������ҺB���Ȼ�������Һ�������������������C������ͭ����ȡ�����Ȼ������ܽ�����D����Ӧ�������ᣬEΪ�Ȼ��������Ȼ�������������Ӧ�����Ȼ���������FΪ�������ݴ˻ش�٢ڢۡ�
��1�������ж����ЧӦ����Һû�У������Fe(OH)3�����FeCl3��Һ�ķ�������ƽ�й��������ַ�ɢϵ�����й�����ͨ·���ǽ��壬û������Һ��
��2��FeCl3����Ԫ����+3�ۣ����̬���������ԣ��ܱ���ԭ����ԭ��+2�ۣ�ͭ������0����ͼۣ����л�ԭ�ԣ��ܱ�������+2�ۣ���˫���ű�ʾ������ת�Ƶķ������ĿΪ�� ��
��
��3�������ڵ���KSCN��Һ�ʺ�ɫ��֤����Һ��һ����Fe3+��
��A.�۲���Һ�Ƿ��dz��ɫ������֤������A����
B.���Թ��м�����Һ���������Ը��������Һ������ɫ��֤������Fe2+����B��ȷ��
C.�Թ��м�����Һ��������ˮ���ٵ���KSCN��Һ������Ѫ��ɫ��֤��ԭ��Һ�к���Fe2+��Ӧ�����ȼ������軯�أ�����ɫ���ټ�����ˮ������ʾ��ɫ��֤�����������ӣ���C����
�ʴ�ΪB��
��4����������������֪��
��Ӧ��ķ�Һ�м�������Ľ���Fe��������Ӧ��Fe+CuCl2 =FeCl2 +Cu��Ȼ����˵õ���ҺB�к���FeCl2������C�к���Fe��Cu���������м�����������ᣬ������Ӧ��Fe+2HCl= FeCl2 + H2������ҺE�к���FeCl2����������ҺB��ϣ�Ȼ�������Һ�еμ����ƵĹ�������ˮ��������Ӧ2FeCl2 +Cl2=2FeCl3�����õ�FeCl3��Һ�����ԣ�
������C�Ļ�ѧʽΪFe��Cu��
�ڼӹ������ᷢ����Ӧ�����ӷ���ʽΪFe+2H+=Fe2++H2����
��ͨ��������Ŀ���ǽ���Һ�е�Fe2��ת��ΪFe3������Ӧ�Ļ�ѧ����ʽΪ��2FeCl2+Cl2=2FeCl3��

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�