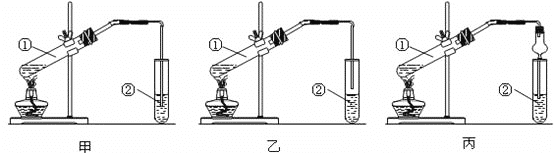
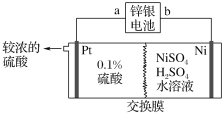
��Ŀ����
����Ŀ����.�Ӻ�ˮ�õ��Ĵ�ʳ��ˮ�г���Ca2����Mg2����SO42-����Ҫ�����ᴿ�����к�����CaCl2��MgSO4�Ĵ�ʳ��ˮ���ڳ�ȥ���������ɳ֮��Ҫ��4���Լ������ᡢ��Na2CO3����NaOH����BaCl2����ȥʳ��ˮ��Ca2����Mg2����SO42-���ᴿ�IJ�������ͼ����Լ��������ͼ��
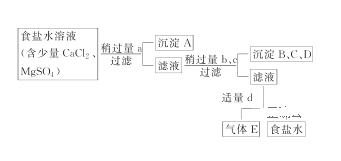
ͼ��a��b��c��d�ֱ��ʾ����4���Լ��е�һ�֣��Իش�
(1)����A��������________��
(2)�Լ�d��________���ж��Լ�d�Ѿ������ķ�����___________________��
��������d����Һ�з�����Ӧ�����ӷ���ʽΪ___________________________��
(3)�����������������˳�����A��B��C��Dʱ�����õ�________(�����)�������۵�������________��
��.��ˮ�������ɺ�ˮ��õ�ˮ�ij��÷���֮һ����ʵ���������һ������װ�ÿ϶���Ҫ���������е�һ���֣�����ȷ����________(�����)��
��.�������������ʾ����������Եõ���ˮ�����ӵ�ˮ����ȡ�⣬��Ҫ���������е�________(�����)������������Ϊ________����õ�ˮ�м������Ȼ�̼����ȡ�ⵥ�ʵ�ʵ�����Ϊ________��
���𰸡����ᱵ��������þ ���� ��Һ�в��ٲ������� OH����H��=H2O��CO32-��2H��=CO2����H2O �� Բ����ƿ �ڢۢݢ� �� ��Һ©�� ��ȡ��Һ
��������
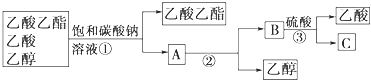
��.��������ӻ��뱵�������ɳ���������þ���ӻ������������Ӻ�̼����������ɳ����������ӻ���̼����������ɳ����������Թ�����a����һ�ֳ�����aΪ�Ȼ������õ��ij���AΪ���ᱵ����Һ�м��Թ������������ƣ���þ��������������þ�����������Թ���̼���ƣ������ӡ��������ı���������̼��ơ�̼�ᱵ�������ʳ���B��C��D�ֱ�Ϊ������þ��̼��ơ�̼�ᱵ��������������������Գ�ȥ������̼���ƺ��������ƣ�
(1)���ݼ�����Լ�ȷ�����ɳ���A��4���Լ��������Na2CO3����NaOH����BaCl2����ȥʳ��ˮ��Ca2+��Mg2+��SO42-�������Լ���˳���Ǣܢۢڢ٣�
(2)����������Ժ�̼�������֮��ķ�Ӧ�������ش�
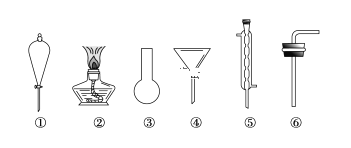
(3)���ݹ���ʵ���õ��������Լ���������������װ����Ҫ�������У��ƾ��ơ�������ƿ���������������ܡ�ţ�ǹܡ���ƿ�������ش�
��.��������װ����Ҫ���������ش�
��.��ȡ��Һ����ʹ�õ������Ƿ�Һ©����
��.þ���������������ӳ���������������������ƿ��Խ�þ���ӳ���������������ñ����ӳ���������������Ȼ������Խ���������ӳ����������ȳ�þ���ӣ������ȳ���������Ӷ��У���������̼������ӳ������������Ӽ���̼����ת��Ϊ���������Ǽ����̼����Ҫ���ڼ�����Ȼ���֮������̼���ƻ��ȥ��Ӧʣ����Ȼ��������Ӷ������ˣ��ٽ��й��ˣ�����ټ��������ȥ��Ӧʣ������������Ӻ�̼������ӣ�
(1)4���Լ��������Na2CO3����NaOH����BaCl2����ȥʳ��ˮ��Ca2+��Mg2+��SO42-�������Լ���˳���Ǣܢۢڢ٣��Ȼ������Խ���������ӳ�������Ӧ�Ļ�ѧ����ʽΪ��MgSO4+BaCl2�TBaSO4��+MgCl2������AΪ��BaSO4��
(2)�Լ�d�����ᣬĿ���dz�ȥ��Һ�к��еĹ���OH-��CO32-��������Ժ�̼�������֮�䷴Ӧ����ˮ�Լ�������̼�������ٲ���������̼ʱ��֤�������Ѿ��������漰�����ӷ�Ӧ����ʽΪOH����H��=H2O��CO32-��2H��=CO2����H2O��
(3)����ʵ���õ���������©�������������ձ��ȣ�����ʵ��װ�ã����˳�����A��B��C��Dʱ�����õ�©������װ�âܣ�װ�â�ΪԲ����ƿ��
��.����װ����Ҫ�������У��ƾ��ơ�������ƿ���������������ܡ�ţ�ǹܡ���ƿ���ʴ�Ϊ�ڢۢݢޣ�
��.�ӵ�ˮ����ȡ�⣬���Բ�ȡ��ȡ��Һ������ʹ�õ���ȡ�������Ȼ�̼��ʹ�õ������Ǣ٣�������Ϊ��Һ©����

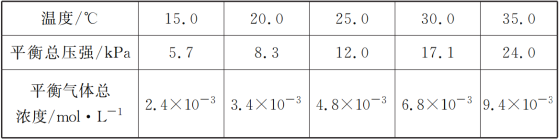
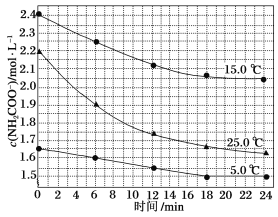
����Ŀ��E��F�����ܱ������У���һ�������·�����Ӧ��E(s)+4F(g)![]() G(g)����֪�÷�Ӧ��ƽ�ⳣ��ֵ���±���ʾ������˵����ȷ����
G(g)����֪�÷�Ӧ��ƽ�ⳣ��ֵ���±���ʾ������˵����ȷ����
�¶ȡ� | 25 | 80 | 230 |
ƽ�ⳣ��ֵ | 5��104 | 2 | 1.9�� 10��5 |
A.������Ӧ��������Ӧ
B.25��ʱ����ӦG(g)![]() E(s)+4F(g)��ƽ�ⳣ��ֵ��0.5
E(s)+4F(g)��ƽ�ⳣ��ֵ��0.5
C.��80��ʱ�����ijʱ�̣�F��GŨ�Ⱦ�Ϊ0.5 mol��L��1�����ʱv(��)��v(��)
D.���º����£����������ٳ�������G(g)������ƽ��ʱ��G������ٷֺ���������