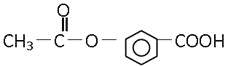
题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成___而使Cu2O产率降低。
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=___。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
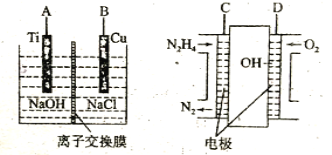
①上述装置中B电极应连___电极(填“C”或“D”)。
②该离子交换膜为___离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为___。
③原电池中负极反应式为___。
【答案】Cu +34.5kJ·mol-1 D 阴 2Cu-2e-+2OH-=Cu2O+H2O N2H4-4e-+4OH-=N2↑+4H2O
【解析】
(1)碳粉能把氧化铜还原为铜粉;
(2)利用盖斯定律计算2CuO(s)+C(s)=Cu2O(s)+CO(g)的焓变;
(3)根据装置图,Cu生成Cu2O,金属铜失电子发生氧化反应,铜为阳极;肼燃料电池中通入氧气的一极发生还原反应,所以D是正极、C是负极。
(1)碳粉能把氧化铜还原为铜粉,若控温不当易生成Cu而使Cu2O产率降低;
(2)①2Cu(s)+![]() O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
根据盖斯定律①+②-③×2得:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5kJ·mol-1;
(3)①根据装置图,Cu生成Cu2O,铜元素失电子发生氧化反应,铜为阳极,B电极连正极,应与肼燃料电池的D电极相连;
②根据题意,需要通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,所以该离子交换膜为阴离子交换膜;阳极铜失电子生成Cu2O,电解池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O;
③肼燃料电池中,燃料肼在负极失电子生成氮气和水,负极反应方程式是N2H4-4e-+4OH-=N2↑+4H2O。