题目内容
2.原子序数小于18的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是( )| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
分析 原子序数小于18的元素X,其原子最外层中未成对电子数最多,p能级含有3个电子,故最外层电子数为5,该元素为N元素或P元素,结合化合价及形成的酸根离子判断.
解答 解:A、XO3-中X的化合价为+5,N可以形成硝酸根离子,故A正确;
B、N、P元素不能形成酸根XO32-,故B错误;
C、XO42-中X的化合价为+6,故C错误;
D、P元素可以形成PO43-,故D正确;
故选AD.
点评 本题考查原子结构与元素关系、元素的性质等,难度不大,推断元素是关键.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
13.关于化合物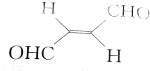 ,下列叙述正确的有( )
,下列叙述正确的有( )
 ,下列叙述正确的有( )
,下列叙述正确的有( )| A. | 分子间可形成氢键 | B. | 分子中既有极性键又有非极性键 | ||
| C. | 分子中有7个σ键和1个π键 | D. | C原子的杂化方式是sp2和sp3 |
17.下列事实不能用键能的大小来解释的是( )
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF比H2O稳定 | |
| D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
14.近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深.Butylated Hydroxy Toluene(简称BHT)是一种常用的食品抗氧化剂,合成方法有如下两种:

下列说法正确的是( )

下列说法正确的是( )
| A. |  能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 | B. |  与BHT互为同系物 与BHT互为同系物 | ||
| C. | BHT久置于空气中不会被氧化 | D. | 两种方法的反应类型都是加成反应 |
12.如图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒.下列关于此装置的叙述中,不正确的是( )


| A. | M上有气体放出 | |
| B. | M为负极,N为正极 | |
| C. | 化学能转变为电能的装置 | |
| D. | 导线中有电流通过,电流方向由N到M |
