题目内容
11.下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.Ⅰ.该小组用图1所示装置进行乙醇制乙烯的实验.当温度迅速上升后,可观察到试管中溴水褪色,蒸馏烧瓶中液体呈棕黑色.实验后,将烧瓶中的废液倒入盛有水的塑料桶中.
(1)写出乙醇制乙烯的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,该反应属于消去反应
(2)有一些同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,因为棕黑色物质会与浓硫酸反应生成某气体,该气体能使溴水褪色,则该气体与溴水反应的化学方程式为SO2+Br2+2H2O═2HBr+2H2SO4.
另有一些同学经过细致观察后认为:试管中的另一个现象可证明反应中有乙烯生成且乙烯具有不饱和性.这个现象是试管底部有油状液体生成.
Ⅱ.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂为银氨溶液,出现的主要现象是:出现银镜或新制氢氧化铜悬浊液,产生砖红色沉淀.(用所学的知识回答)
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想(请你补足猜想②).:
①溴与乙醛发生取代反应;②溴与乙醛发生加成反应;③由于醛基具有还原性,溴将乙醛氧化为乙酸.
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量.
(3)方案一是否可行否(填“是”或“否”),理由是不论是发生取代反应还是氧化反应,溶液的酸性均增强,无法确定反应类型.
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为a mol,若测得反应后
n(Br-)=amol,则说明溴与乙醛发生取代反应.
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2.②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL.③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g.若已知CH3COOAg易溶于水.
试通过计算判断:溴与乙醛发生反应的化学方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr
小张同学认为合适的酸既不是硫酸也不是盐酸,理由是Cl-、SO42-与过量的Ag+作用也产生沉淀,干扰实验的进行.
分析 Ⅰ.(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯;
(2)浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,二氧化硫含有还原性与溴单质发生氧化还原反应;乙烯和溴发生加成反应生成溴代烃,溴代烃不溶于水且密度大于水;
Ⅱ.(1)醛类物质可以和银氨溶液或新制的氢氧化铜悬浊液反应;
(2)根据乙醛的结构、化学性质判断乙醛与溴水可能发生的反应类型;
(3)根据①乙醛与溴发生取代反应和③发生氧化还原反应后的溶液都为酸性溶液分析;
(4)由于乙醛是足量的,溴水中的溴全部参与反应:取代反应后生成n(Br-)=a mol,加成反应后n(Br-)=0 mol,氧化反应后n(Br-)=2amol据此进行解答;
(5)依据加入过量AgN03溶液,得到淡黄色沉淀为AgBr,根据质量求出其物质的量,再分析反应;盐酸和硫酸中的阴离子都和银离子反应生成沉淀.
解答 解:Ⅰ.乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;消去;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,自身被还原生成二氧化硫,C+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,
若乙烯具有不饱和性,乙烯和溴发生加成反应生成溴代烷,溴代烷和水不互溶,且密度大于水,和水混合会分层,且下层有油状液体存在,所以试管底部有油状液体生成可证明反应中有乙烯生成且乙烯具有不饱和性,
故答案为:SO2+Br2+2H2O═2HBr+2H2SO4;试管底部有油状液体生成;
Ⅱ.(1)乙醇催化氧化的产物是乙醛,乙醛可以和新制银氨溶液反应得到银镜或与新制的氢氧化铜悬浊液反应生成砖红色沉淀氧化亚铜,
故答案为:银氨溶液;出现银镜或新制氢氧化铜悬浊液,产生砖红色沉淀;
(2)由于乙醛是足量的,溴水中的溴全部参与反应,可能发生的反应有三种情况:取代反应、加成反应、氧化反应,所以②为溴与乙醛发生加成反应,
故答案为:溴与乙醛发生加成反应;
(3)由于乙醛与溴发生取代反应,反应后溶液为酸性,而发生氧化还原反应后的溶液也是酸性,故若用pH试纸检测褪色后溶液的酸性明显增强,不论是发生取代反应还是氧化反应,溶液的酸性均增强,无法确定反应类型,
故答案为:否;不论是发生取代反应还是氧化反应,溶液的酸性均增强,无法确定反应类型;
(4)由于乙醛是足量的,乙醛中官能团为-CHO,溴水中的溴全部参与反应:取代反应后生成n(Br-)=a mol,加成反应后n(Br-)=0 mol,氧化反应后n(Br-)=2amol,
故答案为:a;
(5)得到固体0.188g为AgBr的质量,n(AgBr)=$\frac{0.188g}{188g/mol}$=0.001mol,10mL含0.005mol Br2,n(Br-)=2n(Br2),则反应应为氧化反应,其反应方程式为:CH3CHO+Br2+H2O→CH3COOH+2HBr;合适的酸既不是硫酸也不是盐酸是因为Cl-、SO42-与过量的Ag+作用也产生沉淀,干扰实验的进行;
故答案为:CH3CHO+Br2+H2O→CH3COOH+2HBr;Cl-、SO42-与过量的Ag+作用也产生沉淀,干扰实验的进行.
点评 本题考查了醛基官能团的性质和检验应用,乙醇的催化氧化实验,注意从取代反应、加成反应、氧化反应的反应特征分析,题目难度中等.

| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
| A. | XO3- | B. | XO32- | C. | XO42- | D. | XO43- |
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 熔点:金刚石>Hg>KCl>HCl |
| A. | CH3CH2CH2CH2CH3 | B. | 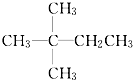 | C. | 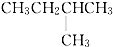 | D. | 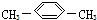 |
 同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是( )
同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是( )| A. | 原子序数:W>Z>X | |
| B. | 气态氢化物的稳定性:N>R | |
| C. | Y和W形成共价化合物 | |
| D. | X和Z两者最高价氧化物对应的水化物能相互反应 |
| 族 周期 | ⅠA | 0 | ||||||
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2He | ||
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
(2)下列有关元素性质的递变规律正确的是C
A、氢氧化物的碱性E<F<G
B、获得电子的能力I>J>K
C、气态氢化物的稳定性D>K
D、原子半径H<I<J<K.
 按以下步骤从
按以下步骤从 合成
合成  .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 、D
、D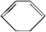 .
.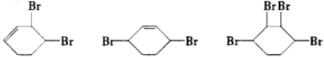 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$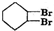 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.