题目内容
14.欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示.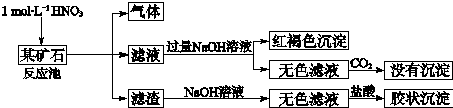
(1)Si在周期表中的位置是第三周期、ⅣA族.
(2)下列说法正确的是ac.
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)该矿石的组成是FeCO3和SiO2,滤渣和NaOH溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O.
(4)该矿石和1mol L-1HNO3反应的离子方程式3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O.
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,用化学方程式解释该方法的目的:4NO+3O2+2H2O=4HNO3,使NO循环使用减少环境污染,提高原料中N的利用率;若按以上方案:NO与O2循环通入反应池处理该矿石2.36103 kg,得到滤渣1.2103 kg,理论上至少需要1mol L-1 HNO3的体积为3×104L.
分析 (1)根据硅的原子核外电子排布确定在周期表中的位置;
(2)a.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
b.对应的酸越强,则酸根离子得到质子的能力越弱;
c.元素的非金属性越强,对应的氢化物越稳定;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小;
(3)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2;
(4)矿石含有FeCO3,可与HNO3反应;
(5)处理该矿石,逸出的气体为NO,可与氧气反应生成硝酸,可循环利用,结合反应的方程式计算.
解答 解:(1)硅的原子核外有3个电子层,最外层电子数为4,则应位于周期表第三周期、ⅣA族,
故答案为:第三周期、ⅣA族;
(2)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
b.酸性:H2CO3>HCO3->Al(OH)3,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:AlO2->CO32->HCO3-,故b错误;
c.非金属性O>C>Si,元素的非金属性越强,对应的氢化物越稳定,故c正确;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小,则O2->Al3+,故d错误;
故答案为:ac;
(3)矿石加硝酸生成气体,可说明含有FeCO3,加入过量NaoH溶液后通入过量二氧化碳没有沉淀生成,说明没有Al2O3,滤渣溶解后加入盐酸生成胶状沉淀,说明含有SiO2,
滤渣和NaOH溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
故答案为:FeCO3和SiO2;SiO2+2OH-=SiO32-+H2O;
(4)矿石含有FeCO3,可与HNO3反应,离子方程式为3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O,
故答案为:3FeCO3+10H++NO3-=3Fe3++3CO2↑+NO↑+5H2O;
(5)由于NO是有毒气体,不能随意排放,所以这样做的目的是NO循环使用能减少环境污染,4NO+3O2+2H2O=4HNO3,且NO跟H2O、O2反应后又得到硝酸提高原料利用率.根据以上分析可知,该矿石中含有碳酸亚铁和二氧化硅,其中碳酸亚铁的质量是2.36×103 kg-1.2×103 kg=1.16×103kg,物质的量是10000mol,则根据(4)中的方程式可知,消耗硝酸的物质的量是$\frac{1{0}^{5}}{3}$mol,所以理论上至少需要1molL-1 HNO3的体积为3.0×104L.
故答案为:4NO+3O2+2H2O=4HNO3,NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率;3×104.
点评 该题综合考查粗硅的制备、元素周期律的应用、物质的检验、氧化还原反应方程式的书写、尾气处理和原料的使用以及有关计算,是高考中的常见题型,难度较大,试题综合性强.

| A. | 酯类物质是形成水果香味的主要成分 | |
| B. | 糖类物质都具有相同的官能团 | |
| C. | 油脂的皂化反应生成高级脂肪酸和甘油 | |
| D. | 蛋白质的水解产物都含有羧基和羟基 |
| A. | 二氧化氯是强氧化剂 | B. | 二氧化氯是强还原剂 | ||
| C. | 二氧化氯是电解质 | D. | 二氧化氯分子中氯为-1价 |
| A. | 平衡向右移动 | B. | x+y>z | C. | B的转化率提高 | D. | C的体积分数增加 |
| A. | H2 | B. | CH2O2 | C. | C6H12O6 | D. | C12H22O11 |
| A. | 3n-12 | B. | 5n-12 | C. | 3n-6 | D. | n-10 |
| A. | H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强 | |
| B. | 根据非金属性强弱F>Cl,可以推测沸点HF>HCl | |
| C. | 进行H2O和H2S气体的热分解实验,可确定S、O两种元素的非金属性强弱 | |
| D. | 已知2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,说明C的非金属性比Si强 |
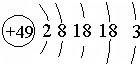 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In的最高正化合价为+3 | ||
| C. | In容易导电导热 | D. | In和铝同主族,金属性比铝弱 |
| A. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 | |
| B. | SiO2晶体熔化时破坏的是共价键;所以CO2晶体熔化时破坏的也是共价键 | |
| C. | 可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝 | |
| D. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |