题目内容
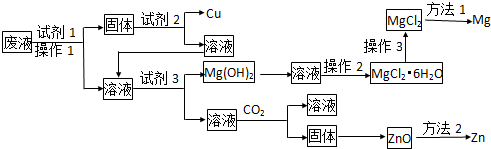
20.该小组根据上述原理设计下图所示装置制备Na2S2O3.
(1)实验应避免有害气体排放到空气中.装置①、②中盛放的试剂依次是
①Na2S 溶液、Na2CO3溶液;
②NaOH溶液.
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是沉淀逐渐消失.
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3•5H2O晶体的主要操作包括:加热浓缩,冷却.结晶,过滤.
分析 图所示装置制备Na2S2O3,利用的原理是亚硫酸钠和浓硫酸反应生成二氧化硫气体,二氧化硫通过硫化钠和碳酸钠的混合溶液,发生反应的化学方程式为:Na2CO3+SO2=Na2SO3+CO2,2Na2S+SO2=3S+2Na2SO3,Na2SO3+S=Na2S2O3;
(1)①上述分析可知①中盛放试剂为Na2S 溶液、Na2CO3溶液;
②为避免污染气体二氧化硫排放到空气中,需要通过氢氧化钠溶液吸收;
(2)随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体沉淀会消失亚硫酸钠和硫单质反应生成硫代硫酸钠;
(3)溶液中得到溶质晶体的操作为加热浓缩,冷却结晶,过滤洗涤得到.
解答 解:图示装置制备Na2S2O3的原理,利用的是亚硫酸钠和浓硫酸反应生成二氧化硫气体,二氧化硫通过硫化钠和碳酸钠的混合溶液,发生反应的化学方程式为:Na2CO3+SO2=Na2SO3+CO2,2Na2S+SO2=3S+2Na2SO3,Na2SO3+S=Na2S2O3;
(1)①上述分析可知①中盛放试剂为生成硫代硫酸钠的装置,试剂应是Na2S 溶液、Na2CO3溶液,发生反应Na2CO3+SO2=Na2SO3+CO2,2Na2S+SO2=3S+2Na2SO3,Na2SO3+S=Na2S2O3,生成目标产物;
故答案为:Na2S 溶液、Na2CO3溶液;
②为避免污染气体二氧化硫排放到空气中,需要通过氢氧化钠溶液吸收,SO2+2NaOH=Na2SO3+H2O,②中盛放的试剂是氢氧化钠溶液,
故答案为:NaOH溶液;
(2)随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,Na2CO3+SO2=Na2SO3+CO2,2Na2S+SO2=3S+2Na2SO3,继续通入气体沉淀会消失,是因亚硫酸钠和硫单质反应生成硫代硫酸钠,Na2SO3+S=Na2S2O3,则观察到的现象为沉淀逐渐消失,
故答案为:沉淀逐渐消失;
(3)溶液中得到溶质晶体的操作为加热浓缩,冷却结晶,过滤洗涤得到,反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3•5H2O晶体的主要操作包括加热浓缩,冷却结晶,过滤洗涤;
故答案为;加热浓缩,冷却结晶,过滤洗涤.
点评 本题考查了物质制备实验装置和原理的分析判断,主要是制备反应的过程理解应用,制备反应和实验基本操作是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 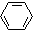 +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$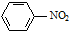 +H2O +H2O | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$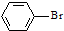 +HBr +HBr |
 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: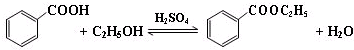
已知(Mr=122)(Mr=150)
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在100mL圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按图所示装好仪器,并在分水器中预先加入水,使水面略低于分水器的支管口,控制温度在65~70℃加热回流2h.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210~213℃的馏分.
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
(1)步骤①中使用分水器不断分离除去水的目的是分离产生的水,使平衡向正反应方向移动,提高转化率.
(2)反应结束的标志分水器中的水层不再增加时,视为反应的终点.
(3)步骤②中应控制馏分的温度在C.
A.65~70℃B.78~80℃C.85~90℃D.215~220℃
(4)若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华.
(5)关于步骤④中的分液操作叙述正确的是AD.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(6)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有蒸馏烧瓶,温度计.
(7)该实验的产率为90%.
| A. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相同 |
| A. | C和CO | B. | 红磷和白磷 | ||
| C. | 3molC2H2(乙炔)和1molC6H6(苯) | D. | 1gH2和2gH2 |

 (1)基态铬原子的价电子排布式为3d54s1.
(1)基态铬原子的价电子排布式为3d54s1.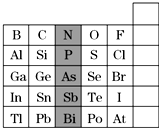 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分: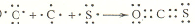 .
.