题目内容
15.A、B、C为三种链烃,A为乙烷,B为乙炔,C为1-丁烯,且A、B、C三种物质按物质的量1:1:2混合,标准状况下该混合物和过量O2组成的混合气体840mL,电火花点燃,将燃烧后的产物用过量碱石灰吸收,碱石灰增重0.93g.试求:碱石灰吸收后所剩气体在标准状况下的体积.
分析 A为乙烷,B为乙炔,C为1-丁烯,且A、B、C三种物质按物质的量1:1:2混合,混合物的平均分子组成为C3H6,燃烧方程式为:C3H6+4.5O2$\frac{\underline{\;点燃\;}}{\;}$3CO2+3H2O,碱石灰增重0.93g为燃烧生成二氧化碳、水的质量,由方程式可知二者物质的量相等,进而计算二氧化碳的物质的量,根据碳元素守恒计算原混合烃的物质的量,再根据V=nVm计算混合烃的体积,结合方程式计算参加反应的烃、氧气的总体积,进而计算剩余气体的体积.
解答 A为烷烃,B为炔烃,C为烯烃,且A、B、C三种物质按物质的量1:1:2混合,则平均碳原子数目=$\frac{2×1+2×1+4×2}{1+1+2}$=3,H原子平均数目=$\frac{6×1+2×1+8×2}{1+1+2}$=6,则混合物的平均分子组成为C3H6,
由C3H6+4.5O2$\frac{\underline{\;点燃\;}}{\;}$3CO2+3H2O,可知:设生成CO2为x mol,水也为x mol,则有44x+18x=0.93,解得=0.015mol,所以原混合气体中n(烃)=$\frac{0.015mol}{3}$=0.005mol,
A、B、C三种烃的体积共为:0.005mol×22.4L/mol=0.112L=112mL,
结合方程式可知,参加反应的气体总体积为:112mL×(1+4.5)=616mL,
剩余气体的体积=840mL-616mL=224mL,
答:碱石灰吸收后所剩气体在标准状况下的体积为224mL.
点评 本题考查混合物反应的计算,题目难度中等,试题侧重考查学生的分析思维能力,注意明确平均分子式、质量守恒定律在有机物燃烧中的计算方法.

练习册系列答案
相关题目
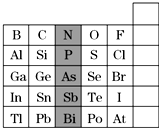
6.有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素 原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2.E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
(1)五种元素的名称:A氧,C硫,E铝.
(2)画出A离子的结构示意图: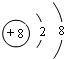
(3)B、C、D元素的原子半径由小到大的顺序为P>S>Cl(用元素符号表示),它们的最高价氧化物对应水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4(用对应的酸表示)
(4)A与E形成的化合物的化学式是Al2O3,它的性质决定了它在物质的分类中应属于两性氧化物.
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清,有关反应的离子方程式为Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O.
| A | ||
| B | C | D |
(2)画出A离子的结构示意图:
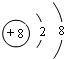
(3)B、C、D元素的原子半径由小到大的顺序为P>S>Cl(用元素符号表示),它们的最高价氧化物对应水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4(用对应的酸表示)
(4)A与E形成的化合物的化学式是Al2O3,它的性质决定了它在物质的分类中应属于两性氧化物.
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清,有关反应的离子方程式为Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O.
3.将3.48g四氧化三铁完全溶解在100mL 1mol•L-1 的硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
| A. | 0.05mol•L-1 | B. | 0.1mol•L-1 | C. | 0.2mol•L-1 | D. | 0.3mol•L-1 |
20.对复杂的有机物结构可用“键线式”表示.如苯丙烯酸丙烯酯: 可简化为:
可简化为: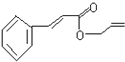 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: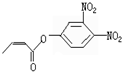 ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
 可简化为:
可简化为: 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )| A. | 遇FeCl3溶液均显紫色 | B. | 均能发生氧化反应 | ||
| C. | 均能与溴水发生反应 | D. | 均能与NaOH溶液发生反应 |
4.等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量比加热前增加的是( )
| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
5.某元素R原子最外层电子数为电子总数的$\frac{1}{3}$,该元素的氧化物可能是( )
| A. | R2O | B. | R2O2 | C. | RO2 | D. | R2O5 |
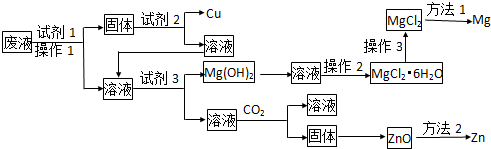
 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分: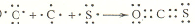 .
.
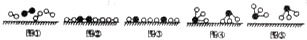
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.