题目内容
2.有甲、乙两种固体,另外有A、B、C、D、E、F六种溶液,它们分别是NaOH、Mg(NO3)2、NaNO3、MgCl2、稀HCl和稀HNO3中的某一种,它们之间相互转变的关系如下:①溶液A+溶液C→固体甲+溶液D
②固体乙+溶液F→溶液E+氢气
③固体甲+溶液B→溶液C+水
(1)写出下列物质的化学式:固体乙Mg,溶液EMgCl2溶液B稀HNO3溶液F稀HCl
(2)写出反应①的化学方程式2NaOH+Mg(NO3)2=Mg(OH)2↓+2NaNO3.
分析 ①溶液A+溶液C→固体甲+溶液D,则A、C为NaOH、Mg(NO3)2,D为NaNO3,固体甲为Mg(OH)2;
②固体乙+溶液F→溶液E+氢气,则溶液F为稀HCl、溶液E为MgCl2、固体乙为金属Mg;
③固体甲+溶液B→溶液C+水,固体甲为Mg(OH)2、D为NaNO3、C为Mg(NO3)2,则固体B为稀HNO3;
根据①③可知,A为NaOH,据此进行解答.
解答 解:①溶液A+溶液C→固体甲+溶液D,则A、C为NaOH、Mg(NO3)2,D为NaNO3,固体甲为Mg(OH)2;②固体乙+溶液F→溶液E+氢气,则溶液F为稀HCl、溶液E为MgCl2、固体乙为金属Mg;③固体甲+溶液B→溶液C+水,固体甲为Mg(OH)2、D为NaNO3、C为Mg(NO3)2,则固体B为稀HNO3;根据①③可知,A为NaOH,
(1)根据分析可知,固体乙为金属Mg,溶液E为MgCl2,溶液B为稀HNO3,溶液F为稀HCl,
故答案为:Mg;MgCl2;稀HNO3;稀HCl;
(2)反应①为氢氧化钠与硝酸镁反应生成氢氧化镁沉淀和硝酸钠,反应的化学方程式为:2NaOH+Mg(NO3)2=Mg(OH)2↓+2NaNO3,
故答案为:2NaOH+Mg(NO3)2=Mg(OH)2↓+2NaNO3.
点评 本题考查物质的检验与鉴别,为高考的常见题型,属于中等难度的试题,熟练掌握常见物质性质及检验方法为解答关键,试题综合性强,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.

练习册系列答案
相关题目
12.下列离子方程式正确的是( )
| A. | 苯酚钠中通二氧化碳反应:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| B. | 电解饱和食盐水:2H++2Cl?$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | Na2CO3溶液显碱性:CO32-+H2O═HCO3-+OH- | |
| D. | 足量AlCl3溶液与纯碱溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
13.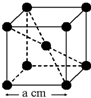 已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
 已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )| A. | NA•a3•ρ | B. | $\frac{{N}_{A}•{a}^{3}•ρ}{6}$ | C. | $\frac{{N}_{A}•{a}^{3}•ρ}{4}$ | D. | $\frac{{N}_{A}•{a}^{3}•ρ}{2}$ |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | 碳酸钠溶液呈碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
7.下列反应中一定有白色沉淀生成的是( )
| A. | 将久置的亚硫酸钠溶液中加入氯化钡溶液再加入稀盐酸 | |
| B. | 向碳酸钠溶液中加入酸性氯化钙溶液 | |
| C. | 向亚硫酸钠溶液中通入氯气再加入氯化钡和稀盐酸 | |
| D. | 向亚硫酸钠溶液中加入稀硝酸后再加入氯化钡溶液 | |
| E. | 二氧化硫通入氯化钡溶液中 |
13.下列关于氧化还原反应中电子转移数目的判断不正确的是( )
| A. | 5.6g铁粉与氯气充分反应失去的电子数一定为0.3NA | |
| B. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeCl2溶液中通入Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.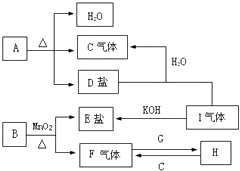 已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题:
已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题: