题目内容
17.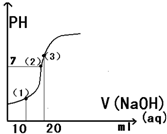 常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )| A. | 点(1)所示溶液中:C(CH3COOH)+C(H+)=C(CH3COO-)+C(OH-) | |
| B. | 点(2)所示溶液中:C(Na+)=C(CH3COO H )+C(CH3COO-) | |
| C. | 点(3)所示溶液中:C(Na+)>C(OH-)>C(CH3COO-)>C(H+) | |
| D. | 滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-) |
分析 A、点(1)所示溶液是用10ml 0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,得到等浓度的醋酸和醋酸钠溶液,结合溶液中电荷守恒和物料守恒计算分析;
B、点(2)所示溶液显中性,为醋酸钠和少量醋酸溶液的混合溶液;
C、点(3)所示溶液中,20ml 0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液恰好反应生成醋酸钠溶液,醋酸根离子水解显碱性;
D、滴定过程中少量滴入氢氧化钠可能出现醋酸多的混合溶液,溶液显酸性;
解答 解:A、点(1)所示溶液是用10ml 0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,得到等浓度的醋酸和醋酸钠溶液,结合溶液中电荷守恒和物料守恒计算分析,溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)c,2c(Na+)=c(CH3COO-)+c(CH3COOH),C(CH3COOH)+2C(H+)=C(CH3COO-)+2C(OH-),故A错误;
B、点(2)所示溶液显中性,为醋酸钠和少量醋酸溶液的混合溶液,C(Na+)<C(CH3COO H )+C(CH3COO-),故B错误;
C、点(3)所示溶液中,20ml 0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液恰好反应生成醋酸钠溶液,醋酸根离子水解显碱性,溶液中离子浓度大小为:C(Na+)>C(CH3COO-)>C(OH-)>C(H+),故C错误;
D、滴定过程中少量滴入氢氧化钠可能出现醋酸含量多的混合溶液,溶液显酸性,滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-),故D正确;
故选D.
点评 本题考查了酸碱混合溶液定性判断,涉及弱电解质的电离、盐类水解、酸碱中和反应等知识点,根据弱电解质的电离特点、溶液酸碱性及盐类水解等知识点来分析解答,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 一定是熵增反应 | |
| B. | 一定是焓减反应 | |
| C. | 一定是△G<0 | |
| D. | 不一定会自动进行,当给予合适条件时会自动进行 |
| A. | 酒石酸是有机二元酸 | B. | 酒石酸与铝盐性质相似 | ||
| C. | 酒石酸氢钾的溶解度小 | D. | 酒石酸钾的溶解度大 |
| A. | 苯酚钠中通二氧化碳反应:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| B. | 电解饱和食盐水:2H++2Cl?$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | Na2CO3溶液显碱性:CO32-+H2O═HCO3-+OH- | |
| D. | 足量AlCl3溶液与纯碱溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
| A. | 硅是构成一些岩石和矿物的基本元素 | |
| B. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| C. | 高纯度的硅单质广泛用于制作光导纤维 | |
| D. | SiO2既能与酸反应,又能与碱反应,所以它是两性氧化物 |
| A. | Mg>Al>Ca | B. | Al>Na>Li | C. | Al>Mg>Ca | D. | Mg>Ba>Al |
| A. | 将久置的亚硫酸钠溶液中加入氯化钡溶液再加入稀盐酸 | |
| B. | 向碳酸钠溶液中加入酸性氯化钙溶液 | |
| C. | 向亚硫酸钠溶液中通入氯气再加入氯化钡和稀盐酸 | |
| D. | 向亚硫酸钠溶液中加入稀硝酸后再加入氯化钡溶液 | |
| E. | 二氧化硫通入氯化钡溶液中 |
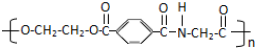 ,则这三种单体的结构简式为CH2OHCH2OH、
,则这三种单体的结构简式为CH2OHCH2OH、 、H2NCH2COOH.
、H2NCH2COOH.