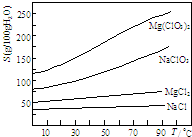
题目内容
12.已知:C(s)+CO2(g)?2CO(g)△H>0.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO2的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体⑦增加Fe的物质的量,能提高CO2转化率的是( )
| A. | ①②⑦ | B. | ②③⑤ | C. | ①④⑥ | D. | ③⑤⑥ |
分析 化学反应C(s)+CO2(g)?2CO(g)△H>0是气体体积增大吸热反应;转化率的变化根据化学平衡的移动方向分析判断.
①升温平衡向吸热反应方向移动;
②恒容通入惰性气体,平衡不移动;
③增加CO2的浓度,平衡正向进行;
④减压平衡向气体体积增大的方向进行,平衡正向进行;
⑤加催化剂,改变速率不改变平衡;
⑥恒压通入惰性气体,相对于减小反应体系的压强,平衡向气体体积增大的方向进行,平衡正向进行;
⑦增加C的物质的量,平衡不移动.
解答 解:化学反应C(s)+CO2(g)?2CO(g)△H>0是气体体积增大吸热反应;转化率的变化根据化学平衡的移动方向分析判断.
①升温平衡向吸热反应方向移动即平衡正向进行,CO2转化率增大,故符合;
②恒容通入惰性气体,平衡不移动,故不符合;
③增加CO2的浓度,虽然平衡正向进行,但CO2转化率减小,故不符合;
④减压平衡向气体体积增大的方向进行,平衡正向进行,CO2转化率增大,故符合;
⑤加催化剂,改变速率不改变平衡,故不符合;
⑥恒压通入惰性气体,相对于减小反应体系的压强,平衡向气体体积增大的方向进行,平衡正向进行,CO2转化率增大,故符合;
⑦增加C的物质的量,平衡不移动,故不符合;
故选C.
点评 本题考查了化学平衡的影响因素的分析判断,体积改变,平衡移动方向是判断的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.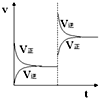 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
 在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )
在密闭容器,一定条件下进行反应,mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )| A. | 正反应是吸热反应 | B. | 逆反应是吸热反应 | ||
| C. | m+n>p+q | D. | m+n<p+q |
4.科学家刚刚发现了某种元素的原子,其质量是ag,12C的原子质量是bg,NA是阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 该原子的摩尔质量是aNAg/mol | |
| B. | Wg该原子的物质的量一定是$\frac{W}{{a{N_A}}}$mol | |
| C. | Wg该原子中含有$\frac{w}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{b}{12}$ |
1.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该试剂的物质的量浓度为9.2mol•L-1 | |
| B. | 该硫酸50mL与足量的铜反应可得到标准状况下SO2 10.3L | |
| C. | 配制50mL 4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |