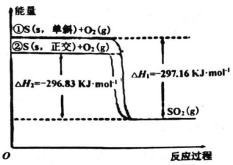
题目内容
【题目】三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
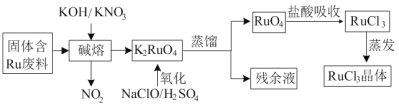
回答下列问题:
(1)K2RuO4中Ru的化合价为_____,“碱熔”中产生的气体可用于____(写一种工业用途)。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,则需要氧化剂的物质的量为______mol。
(3)为了提高“碱熔”效率,可以采取的措施有______。
(4)RuO4气体有剧毒,“盐酸吸收”时的化学方程式为___________。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:
实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.1875 | 2.0210 |
② | 5.1875 | 2.0190 |
③ | 5.1875 | 2.0200 |
④ | 5.1875 | 1.6200 |
则产品的纯度为________(用百分数表示)。
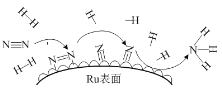
(6)钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式________。
【答案】+6价 用来制取硝酸 2 适当升高温度、粉碎固体废料 2RuO4+16HCl = 2RuCl3+5Cl2↑+8H2O 80.00% N2+3H2![]() 2NH3
2NH3
【解析】
含Ru废料加入硝酸钾和氢氧化钾反应生成二氧化氮和K2RuO4,K2RuO4与NaClO、硫酸反应生成RuO4,RuO4与盐酸反应生成RuCl3、Cl2和H2O。
(1)根据K元素的化合价为+1价,O元素的化合价为2价分析得到K2RuO4中Ru的化合价为+6价,“碱熔”中产生的气体是二氧化氮,二氧化氮可用于制硝酸;故答案为:+6价;用来制取硝酸。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,根据得失电子守恒分析2mol K2RuO4氧化为RuO4失去4mol电子,NaClO中Cl元素的化合价由+1价降为-1价,1mol NaClO得到2mol电子,因此需要氧化剂的物质的量为2 mol;故答案为:2。
(3)为了提高“碱熔”效率,可以采取的措施有适当升高温度、粉碎固体废料;故答案为:适当升高温度、粉碎固体废料。
(4)RuO4气体有剧毒,根据图中信息用“盐酸吸收”时生成RuCl3,Ru化合价降低,则盐酸中氯元素的化合价升高变为氯气,其化学方程式为2RuO4+16HCl = 2RuCl3+5Cl2↑+8H2O;故答案为:2RuO4+16HCl = 2RuCl3+5Cl2↑+8H2O。
(5)根据数据得出第④实验数据误差较大,应舍弃,取另外三次的平均数据,得到Ru质量为2.0200g,产品中RuCl3的质量为![]() g,则产品的纯度为
g,则产品的纯度为![]() ;故答案为:80.00%。
;故答案为:80.00%。
(6)根据图中信息得到氮气和氢气在催化剂作用下反应生成氨气,其合成反应的化学方程式;N2+3H2![]() 2NH3;故答案为:N2+3H2
2NH3;故答案为:N2+3H2![]() 2NH3。
2NH3。

 阅读快车系列答案
阅读快车系列答案