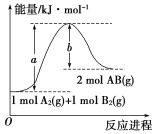
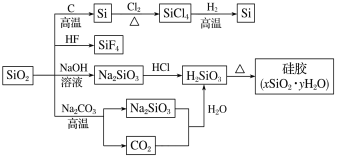
题目内容
【题目】向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应,计算:
(1)Al的物质的量__________。
(2)参加反应的NaOH的物质的量__________和NaOH溶液的物质的量浓度___________。
(3)生成的H2在标准状况下的体积____________。
【答案】0.4mol 0.4mol 0.8mol/L 13.44L
【解析】
(1)依题意可知:铝的物质的量为n=![]() ;
;
(2)设参加反应的NaOH的物质的量为xmol,根据Al和NaOH的反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑及其对应关系求解;
(3) 根据Al和NaOH的反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑中反应物和生成物的对应关系解答。
(1)依题意可知:铝的物质的量为n=![]() =
=![]() mol=0.4mol;
mol=0.4mol;
(2)设参加反应的NaOH的物质的量为xmol,根据Al和NaOH的反应方程式可知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,参加反应的NaOH的物质的量和铝的物质的量相等,即0.4mol,NaOH溶液的物质的量浓度c=![]() =
=![]() =0.8mol/L;
=0.8mol/L;
(3) 根据Al和NaOH的反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知生成H2的物质的量n(H2)= ![]() n(Al)=
n(Al)= ![]() ×0.4mol=0.6mol,标准状况下的体积V=n×Vm=0.6mol×22.4L/mol=13.44L。
×0.4mol=0.6mol,标准状况下的体积V=n×Vm=0.6mol×22.4L/mol=13.44L。

【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为___,有__个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是__。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因__。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是__。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__,微粒之间存在的作用力是__。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__。
,0)。则D原子的坐标参数为__。
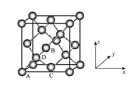
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为__g·cm-3(列出计算式即可)。