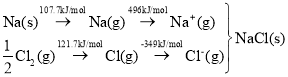题目内容
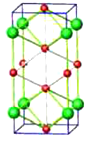
【题目】(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷(P4)和P4O6的分子结构如图所示,
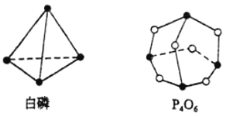
已知:
化学键 | P—P | P—O | O=O |
键能(kJ·mol1) | 198 | 360 | 498 |
则反应P4(g)+3O2(g)= P4O6(g)的△H=_________。
(2)已知①2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则制备水煤气的反应C(s)+H2O(g)=CO(g)+ H2(g)的△H=_______。
【答案】-1638kJ/mol +131.3kJ/mol
【解析】
(1)根据![]() 可以求反应P4(g)+3O2(g)= P4O6(g)的
可以求反应P4(g)+3O2(g)= P4O6(g)的![]()
![]() ,故答案为:-1638kJ/mol;
,故答案为:-1638kJ/mol;
(2)已知①2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol ②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
由盖斯定律可知制备水煤气的反应C(s)+H2O(g)=CO(g)+ H2(g),可由(反应①-反应②)/2得到,故△H=![]() ,故答案为:+131.3kJ/mol
,故答案为:+131.3kJ/mol

 高中必刷题系列答案
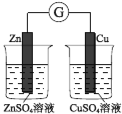
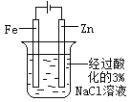
高中必刷题系列答案【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
片刻后在 Fe 电极附近滴入铁氰化钾溶液 |
|
验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证 Fe 电极被保护 | 验证AgCl 溶解度大于Ag2S |
A.AB.BC.CD.D
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
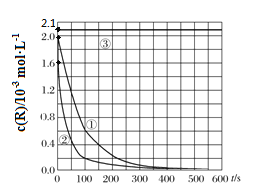
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液