题目内容
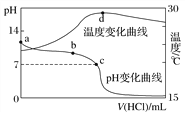
【题目】以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:
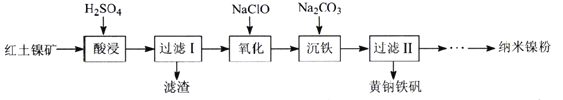
(1)“酸浸”过程,为提高铁和镍元素的浸出率,可采取的措施有___________(写出两种)。
(2)“过滤Ⅰ”滤渣的主要成分是______。
(3)“氧化”过程欲使0.3molFe2+转变为Fe3+,则需氧化剂NaClO至少为________ mol。
(4)“沉铁”过程中加入碳酸钠调节浴液的pH至2,生成黃钠铁矾沉淀,写出该反应的化学方程式______。若碳酸钠过多会导致生成的沉淀由黄钠铁矾转变为_____(填化学式)。
(5)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在不同浓度的氢氧化钠溶液中反应,含镍产物的XRD图谱如下图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯纳米镍粉最适宜的NaOH的物质的量浓度为_____。写出该条件下制备纳米镍粉同时生成N2的离子方程式_____。

(6)高铁酸盐也是一种优良的含铁净水剂,J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为______;Deininger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_______。
【答案】提高反应温度、适当增大硫酸浓度、将原料粉碎、搅拌等(任答两条) SiO2 0.15 2Fe2(SO4)3+6Na2CO3+6H2O=2NaFe(SO4)2(OH)6+5Na2SO4+6CO2↑ Fe(OH)3 0.015mol/L N2H4·H2O+2Ni2++4OH-=2Ni+N2↑+5H2O(或N2H4+2Ni2++4OH-=2Ni+N2↑+4H2O) Fe-6e-+8OH-=FeO42-+4H2O 避免FeO42-在阴极上被还原
【解析】
(1)依据提高原料利用率与化学反应速率的影响因素作答;
(2)红土镍矿中只有二氧化硅不溶于硫酸;
(3)依据氧化还原反应规律与得失电子数守恒计算;
(4)加入碳酸钠“沉铁”生成NaFe(SO4)2(OH)6,依据元素守恒定律书写化学方程式;碳酸钠过多会使溶液显碱性,据此分析;
(5)根据图示信息,找出Ni晶体的衍射峰强度较强对应的氢氧化钠的浓度;依据氧化还原反应规律分析作答;
(6)根据电解原理以及实验目的,Fe作阳极,电解质为NaOH,阳极Fe失电子发生氧化反应生成FeO42-;阳离子交换膜可防止FeO42-在阴极被还原,提高了产率。
(1)可通过提高反应温度、适当增大硫酸浓度、将原料粉碎、搅拌等提高铁和镍元素的浸出率,
故答案为:提高反应温度、适当增大硫酸浓度、将原料粉碎、搅拌等(任答两条);
(2)Fe2O3、FeO、NiO、SiO2经过“酸浸”后,溶液存在Fe3+、Fe2+和Ni2+,只有SiO2不溶于硫酸,作为滤渣被过滤出来,
故答案为:SiO2;
(3)NaClO做氧化剂会将Fe2+氧化为Fe3+,Cl元素由+1价降低到-1价,则易知2Fe2+![]() NaClO,则0.3molFe2+转变为Fe3+,则需氧化剂NaClO至少为0.15 mol,
NaClO,则0.3molFe2+转变为Fe3+,则需氧化剂NaClO至少为0.15 mol,
故答案为:0.15;
(4)NaClO氧化后,溶液中溶质为Fe2(SO4)3,继续在“沉铁”过程中加入碳酸钠调节浴液的pH至2,生成黃钠铁矾沉淀,则化学方程式为:2Fe2(SO4)3+6Na2CO3+6H2O=2NaFe(SO4)2(OH)6+5Na2SO4+6CO2↑,碳酸钠过多,溶液酸性减弱,使pH增大,极易生成Fe(OH)3沉淀,
故答案为:2Fe2(SO4)3+6Na2CO3+6H2O=2NaFe(SO4)2(OH)6+5Na2SO4+6CO2↑;Fe(OH)3;
(5)根据图示数据可以看出,氢氧化钠浓度为0.015mol/L时,仅出现Ni衍射峰,因此制得高纯纳米镍粉最适宜的NaOH的物质的量浓度为0.015mol/L,则碱性条件下制备纳米镍粉同时生成N2的离子方程式为:N2H4·H2O+2Ni2++4OH-=2Ni+N2↑+5H2O(或N2H4+2Ni2++4OH-=2Ni+N2↑+4H2O),
故答案为:0.015;N2H4·H2O+2Ni2++4OH-=2Ni+N2↑+5H2O(或N2H4+2Ni2++4OH-=2Ni+N2↑+4H2O);
(6)根据电解原理以及实验目的,Fe作阳极,电解质为NaOH,因此阳极反应式为Fe-6e-+8OH-=FeO42-+4H2O;阳离子交换膜只允许阳离子通过,FeO42-具有强氧化性,因此阳离子交换膜的作用是避免FeO42-在阴极上被还原;
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;避免FeO42-在阴极上被还原。

【题目】化学反应原理知识在指导工业生产和环保等方面具有重要作用,请回答下列问题:
(1)已知热化学方程式:
①2C(s)+H2(g) = C2H2(g) △H1
②C(s)+O2(g) = CO2(g) △H2
③H2(g) +![]() O2(g) = H2O(l) △H3
O2(g) = H2O(l) △H3
则表示C2H2燃烧热的热化学方程式为____________________________。
(2)利用测压法在刚性反应器中加入2molSO2、1molO2,研究T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 40 |
压强/kPa | 20.0 | 19.5 | 18.3 | 16.0 | 16.0 | 16.0 | 22.0 |
①平衡时,SO2的转化率α= _________ %;
②T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
③下图分别代表焓变(△H)、混合气体平均相对分子(![]() )、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
)、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
A 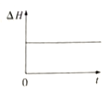 B
B 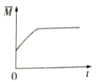 C
C  D
D 
④40min时,改变的条件可能是_______________________________(写2点)。
(3)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结构如图所示。
模拟尾气 | 气体(10 mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量/mol | 0.025 | 0.5 | 9.475 | n |
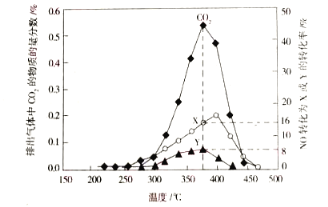
①二氧化碳的电子式为__________________。
②375℃时,测得排出的气体中含0.45molO2和0.0525molCO2,则Y的化学名称为______。