题目内容
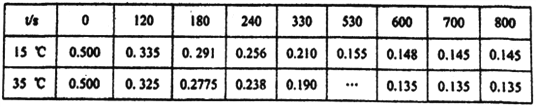
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
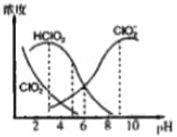
A. 亚氯酸钠在碱性条件下较稳定
B. 25℃时,HClO2的电离平衡常数的数值Ka=10-6
C. 25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
【答案】C
【解析】A项,根据图示在碱性条件下主要含氯微粒为ClO2-,NaClO2在碱性条件下较稳定,A项正确;B项,HClO2的电离方程式为HClO2![]() H++ClO2-,HClO2的电离平衡常数Ka=
H++ClO2-,HClO2的电离平衡常数Ka=![]() ,根据图示当c(HClO2)=c(ClO2-)时溶液的pH=6即c(H+)=1
,根据图示当c(HClO2)=c(ClO2-)时溶液的pH=6即c(H+)=1![]() 10-6mol/L,25℃时HClO2的电离平衡常数的数值Ka=10-6,B项正确;C项,NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,NaClO2溶液中的电荷守恒为c(Na+)+c(H+)=c(ClO2-)+c(Cl-)+c(OH-),C项错误;D项,浓度均为0.1mol/L的HClO2溶液和NaClO2等体积组成的混合液中既存在HClO2的电离平衡(HClO2
10-6mol/L,25℃时HClO2的电离平衡常数的数值Ka=10-6,B项正确;C项,NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,NaClO2溶液中的电荷守恒为c(Na+)+c(H+)=c(ClO2-)+c(Cl-)+c(OH-),C项错误;D项,浓度均为0.1mol/L的HClO2溶液和NaClO2等体积组成的混合液中既存在HClO2的电离平衡(HClO2![]() H++ClO2-)又存在ClO2-的水解平衡(ClO2-+H2O
H++ClO2-)又存在ClO2-的水解平衡(ClO2-+H2O![]() HClO2+OH-),由于混合液呈酸性,HClO2的电离程度大于ClO2-的水解程度,溶液中有关微粒浓度由大到小的顺序为c(ClO2-)
HClO2+OH-),由于混合液呈酸性,HClO2的电离程度大于ClO2-的水解程度,溶液中有关微粒浓度由大到小的顺序为c(ClO2-)![]() c(Na+)
c(Na+)![]() c(HClO2)
c(HClO2)![]() c(H+)
c(H+)![]() c(OH-),D项正确;答案选C。
c(OH-),D项正确;答案选C。