题目内容
【题目】下列说法正确的是( )
A.某有机物燃烧只生成![]() 和
和![]() ,且二者物质的量相等,则此有机物的组成为
,且二者物质的量相等,则此有机物的组成为![]()
B.—定压强下, ![]() 气态烃在足量的氧气中燃烧,将产生的气体通过浓硫酸后气体体积为
气态烃在足量的氧气中燃烧,将产生的气体通过浓硫酸后气体体积为![]() ,则生成的水蒸气的体积为
,则生成的水蒸气的体积为![]()
C.相同质量的烃,完全燃烧,消耗![]() 越多,烃中含氢量越高
越多,烃中含氢量越高
D.某气态烃![]() 与足量
与足量![]() 恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则
恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则![]() ;若体积减小,则
;若体积减小,则![]()
【答案】C
【解析】
A.烯烃及烃的某些含氧衍生物燃烧只生成CO2和H2O,且二者的物质的量相等,则某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n或CnH2nO、CnH2nO2,故A错误;
B.若水为气态,通过浓硫酸后气体体积为V2L,减少的体积为水蒸气的反应,且反应前无氧气的体积,不能计算,故B错误;
C.烃中H元素的质量分数越大,消耗氧气越多,则相同质量的烃,完全燃烧时,含氢元素质量分数越高的烃,消耗O2量越多,故C正确;
D.![]() ,温度大于100℃,水为气态,则
,温度大于100℃,水为气态,则![]() ,可知y=4,若体积减小,则y<4,故D错误;
,可知y=4,若体积减小,则y<4,故D错误;
故答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷(P4)和P4O6的分子结构如图所示,
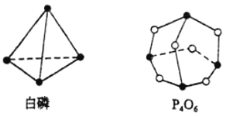
已知:
化学键 | P—P | P—O | O=O |
键能(kJ·mol1) | 198 | 360 | 498 |
则反应P4(g)+3O2(g)= P4O6(g)的△H=_________。
(2)已知①2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则制备水煤气的反应C(s)+H2O(g)=CO(g)+ H2(g)的△H=_______。
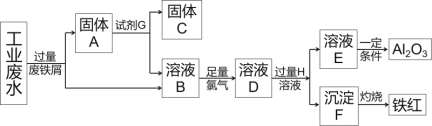
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有___________、__________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | —— | —— | —— |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有___________;但溶液的pH不能超过8,其理由是_____________________。
(4)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_______。