��Ŀ����
����Ŀ��Ŀǰ��ҵ�ϴ����л���ˮ��һ�ַ����ǣ��ڵ��ں�pH��Mn2��Ũ�ȵķ�ˮ�м���H2O2��ʹ�л����������⡣��������¶Ա�ʵ�飨ʵ�������������)��ʵ�����л���RŨ����ʱ��仯�Ĺ�ϵ����ͼ��ʾ������˵����ȷ����
ʵ���� | T/K | pH | c/10��3mol��L��1 | |
H2O2 | Mn2�� | |||
�� | 298 | 3 | 6.0 | 0.30 |
�� | 313 | 3 | 6.0 | 0.30 |
�� | 298 | 9 | 6.0 | 0.30 |
A. 313Kʱ����0~100s���л���R�����ƽ������Ϊ��0.014 mol��L-1��s-1
B. �Ա��٢�ʵ�飬���Եó��¶�Խ��Խ�������л���R�Ľ���
C. �Ա��٢�ʵ�飬���Է���������ʵ�����л���R�Ľ���ٷ��ʲ�ͬ
D. ͨ����������ʵ�飬����ʹ��Ӧֹͣ��������Ӧ��ϵ�м���һ������NaOH��Һ
���𰸡�D
��������
A. 313Kʱ����0~100s���л���R�����ƽ�����ʣ�![]() ��1.4 ��10��5mol��L-1��s-1��A����B. �¶ȹ��ߣ�˫��ˮ���ֽ⣬B����C. �Ա��٢�ʵ�飬���Է���������ʵ�����л���R�Ľ���ٷ�����ͬ��C����D. ͨ����������ʵ�飬����ʹ��Ӧֹͣ��������Ӧ��ϵ�м���һ������NaOH��Һ������pH��D��ȷ����ѡD��
��1.4 ��10��5mol��L-1��s-1��A����B. �¶ȹ��ߣ�˫��ˮ���ֽ⣬B����C. �Ա��٢�ʵ�飬���Է���������ʵ�����л���R�Ľ���ٷ�����ͬ��C����D. ͨ����������ʵ�飬����ʹ��Ӧֹͣ��������Ӧ��ϵ�м���һ������NaOH��Һ������pH��D��ȷ����ѡD��

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�����Ŀ����ϩ�Ǻϳ�ʳƷ���װ���Ͼ���ϩ�ĵ��壬�����ɶ����ѽ��Ʊ���
����Ӧ��C4H10(g,������)![]() C2H4(g)+C2H6(g) ��H1
C2H4(g)+C2H6(g) ��H1
����Ӧ��C4H10 (g,������)![]() CH4(g)+C3H6(g) ��H2
CH4(g)+C3H6(g) ��H2
�ش��������⣺
��1����ѧ�ϣ����ȶ����ʵ�������Ϊ0�������ȶ�������ʱ�ͷŻ����յ��������������ȣ������ȿɱ�ʾ����������������±�Ϊ25�桢101kPa�¼����л���������ȣ�
���� | ���� | ���� | ��ϩ | ��ϩ | ������ | �춡�� |
������/kJ��mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
����д�Ȼ�ѧ����ʽʱ��Ҫ������ͬ���칹�����ơ�����������_______________________��
��������Ӧ�У���H1=______kJ/mol��
��2��һ���¶��£��ں����ܱ�������Ͷ��һ���������鷢����Ӧ������ϩ��
��������������÷�Ӧ�ﵽƽ��״̬����_______������ţ���
A�������ܶȱ��ֲ��� B��[c(C2H4)��c(C2H6)]/ c(C4H10)���ֲ���
C����Ӧ�Ȳ��� D��������ֽ����ʺ����������������
��Ϊ��ͬʱ��߷�Ӧ���ʺ�ת���ʣ��ɲ��õĴ�ʩ��________________��
��3�����ܱ������г��붡�飬��һ��������Ũ�ȡ�������ѹǿ��)�·�����Ӧ�������ϩ�������¶ȹ�ϵ��ͼ��ʾ���¶ȸ���600��ʱ�������¶����ߣ���ϩ���ʽ��ͣ����ܵ�ԭ����__________�������)��
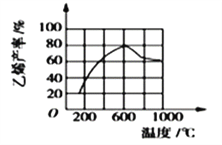
A��ƽ�ⳣ������ B����ܽ���
C���������Խ��� D������������
��4����һ���¶�����1L�����ܱ������г���2mol�����飬��Ӧ������ϩ�����飬����10min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����
��0~10min����ϩ����������v(C2H4)Ϊ________mol��L-1��min-1��
�����������£��÷�Ӧ��ƽ�ⳣ��KΪ____________��
��5������-����ȼ�ϵ�������ڵ�K2CO3Ϊ����ʣ��Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�صĸ�����ӦʽΪ______________________________��
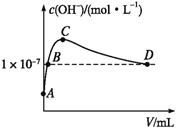
��6��K2CO3���ɶ�����̼������������Һ��Ӧ�Ƶá�������,��1 L pH=10��KOH��Һ�г���ͨ��CO2,ͨ��CO2�����(V)����Һ��ˮ�������OH-Ũ�ȵĹ�ϵ��ͼ��ʾ��C����Һ�и�����Ũ�ȴ�С��ϵΪ_________________________________________��