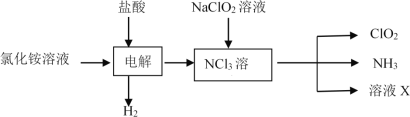
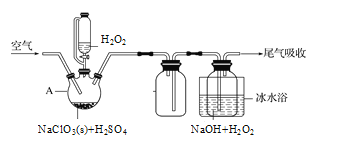
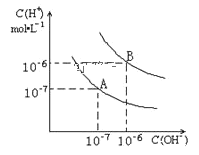
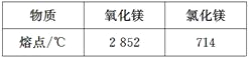
题目内容
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
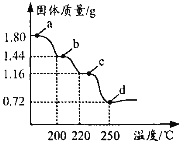
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
【答案】BC
【解析】
A项、1.80gFeC2O42H2O的物质的量为![]() =0.01mol,由图可知,减少的质量为水的质量,减少水的物质的量为
=0.01mol,由图可知,减少的质量为水的质量,减少水的物质的量为![]() =0.02mol,说明结晶水已全部失去,b点的固体成份为FeC2O4,故A错误;
=0.02mol,说明结晶水已全部失去,b点的固体成份为FeC2O4,故A错误;
B项、由铁原子个数守恒,可知1.16g固体中铁的质量为0.56g,阴离子的质量为(1.16—0.56)g=0.60g,损失的质量为(1.44—1.16)g=0.28g,则b→c的反应FeC2O4为受热分解生成FeCO3和CO,故B正确;
C项、b→c的反应中生成一氧化碳的物质的量为![]() =0.01mol,c→d的反应中生成一氧化碳的物质的量为
=0.01mol,c→d的反应中生成一氧化碳的物质的量为![]() =0.01mol,故C正确;
=0.01mol,故C正确;
D项、加热至250℃以上,固体质量略有增加,可能是因为FeO与空气中氧气反应生成了Fe3O4或Fe2O3,故D错误;
故选BC。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
【题目】(I)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为______;反应
H2(g)+I2(g)的平衡常数K2为______;反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K3为________。
HI(g)的平衡常数K3为________。
(II)在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____。
(2)该反应为_____(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L1,c(H2)=1.5mol·L1,c(CO)=1mol·L1,c(H2O)=3mol·L1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。