题目内容
【题目】二氧化氯(ClO2)是黄绿色易溶于水的气体,熔点-59℃、沸点11℃,但其浓度过高时易发生分解,因此常将其制成NaClO2固体便于运输和贮存。回答下列问题:
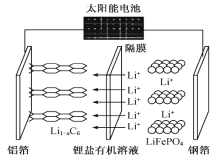
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

①电解时发生反应方程式为__________。
②溶液X中大量存在的溶质有__________(填化学式)。
③除去ClO2中的NH3可选用的试剂是_________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
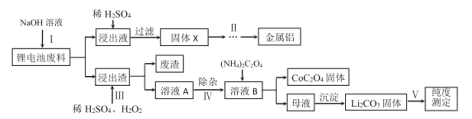
(2)实验室中用过氧化氢法将ClO2制备成NaClO2固体,其实验装置如图所示。
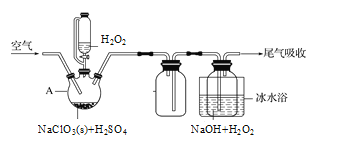
①A中发生的反应为2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O,仪器A的名称是_______。
②写出制备NaClO2固体的化学方程式:__________。冰水浴冷却的目的是________。
③空气流速过快或过慢,均会降低NaClO2的产率,其原因是______________。
④为了测定NaClO2粗品的纯度,取上述粗产品10.0g溶于水配成1L溶液,取出10mL,溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20mol·L-1Na2S2O3标准液滴定,达到滴定达终点时用去标准液20.00mL,试计算NaClO2粗品的纯度_______。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
【答案】NH4Cl+2HCl![]() 3H2+NCl3 NaCl、NaOH c 三颈(口)烧瓶 2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O 减少双氧水分解或减少ClO2的挥发或提高ClO2的溶解度 空气流速过快ClO2反应不充分,空气流速过慢ClO2浓度过高易发生分解 90.5%
3H2+NCl3 NaCl、NaOH c 三颈(口)烧瓶 2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O 减少双氧水分解或减少ClO2的挥发或提高ClO2的溶解度 空气流速过快ClO2反应不充分,空气流速过慢ClO2浓度过高易发生分解 90.5%
【解析】
(1)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,加入NaClO2溶液反应生成ClO2、NH3、溶液X,X中含Cl-、OH-,由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(2)氯酸钠(NaClO3)在酸性条件下与过氧化氢生二氧化氯,ClO2与氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO23H2O;结合滴定原理及发生的反应计算产物的纯度。
(1)①氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,发生反应方程式为NH4Cl+2HCl![]() 3H2+NCl3;
3H2+NCl3;
②加入NaClO2溶液反应生成ClO2、NH3、溶液X,X中含Cl-、OH-,则溶质为NaCl、NaOH;
③由信息可知,ClO2易溶于水,所以不能利用水或水溶液吸收,氨气为碱性气体,可与酸反应,则应选用浓硫酸除去ClO2中的NH3,答案选c;
(2)①A中发生的反应为2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O,仪器A的名称是三颈(口)烧瓶;
②根据分析,ClO2与氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,则制备NaClO2固体的化学方程式:2ClO2+H2O2+2NaOH==2NaClO2+O2↑+2H2O;根据题中信息,ClO2的熔沸点较低,温度过高易挥发,制备NaClO2时使用双氧水,双氧水高温下易分解,导致产率降低,则冰水浴冷却的目的是减少双氧水分解或减少ClO2的挥发或提高ClO2的溶解度;
③空气流速过快ClO2反应不充分,空气流速过慢导致ClO2浓度过高易发生分解;
④含有NaClO2的溶液中加入足量酸化的KI溶液反应,NaClO2被还原为Cl-,离子反应方程式为:ClO2-+4I-+4H+=2I2+Cl-+2H2O,根据2Na2S2O3+I2=Na2S4O6+2NaI,可得关系式:ClO2-~2I2~4Na2S2O3,则1L样品的溶液中n(NaClO2)=![]() ×n(Na2S2O3)×
×n(Na2S2O3)×![]() =
=![]() ×0.20mol·L-1×0.02L×100=0.1mol,则NaClO2粗品的纯度=
×0.20mol·L-1×0.02L×100=0.1mol,则NaClO2粗品的纯度=![]() ×100%=90.5%。
×100%=90.5%。