题目内容
3.下列说法中不正确的是( )| A. | 原子晶体的熔点一定比分子晶体高 | |
| B. | SO2和SO3均是非极性分子 | |
| C. | PCl3分子中P-Cl的键角小于109°28? | |
| D. | 晶体中有阳离子必有阴离子 |
分析 A.原子晶体的熔沸点较高,分子晶体熔沸点较低;
B.二氧化硫是极性分子,三氧化硫是非极性分子;
C.PCl3分子为三角锥形,孤电子对和成键电子之间的排斥力大于成键电子和成键之间的排斥力;
D.晶体中含有阳离子不一定含有阴离子.
解答 解:A.原子晶体的熔沸点较高,分子晶体熔沸点较低,所以原子晶体的熔点一定比分子晶体高,故A正确;
B.二氧化硫分子是V形,是极性分子,三氧化硫是平面三角形,非极性分子,故B错误;
C.PCl3分子为三角锥形,由于该分子中含有孤电子对,导致其键角小于正四面体结构的键角,即小于109°28′,故C正确;
D.晶体中含有阳离子不一定含有阴离子,如金属晶体是由金属阳离子和自由电子构成的,故D错误;
故选BD.
点评 本题考查晶体熔沸点比较、分子构型、分子极性及键角、晶体构成微粒等知识点,为高频考点,会利用价层电子对互斥理论判断分子空间构型,易错选项是D,注意晶体中含有阳离子不一定含有阴离子,但含有阴离子的晶体一定含有阳离子.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
19.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 以乙烯为原料制备二氯乙烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用SiO2制备高纯硅 |
20.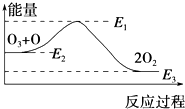 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
大气臭氧层的分解反应是:O3+O═2O2△H,该反应的能量变化如图所示,则下列叙述正确的是( )
 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.大气臭氧层的分解反应是:O3+O═2O2△H,该反应的能量变化如图所示,则下列叙述正确的是( )
| A. | 反应O3+O═2O2的△H=E1-E3 | B. | 反应O3+O═2O2是吸热反应 | ||
| C. | △H=△H1+△H2 | D. | 氯原子没有改变O3分解反应的历程 |
18.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z的原子半径r(T)>r(W)>r(Z) | |
| B. | 由X、Y、Z氢化物的热稳定性X>Y>Z | |
| C. | X最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | W元素的单质具有半导体的特性,可以用于制造光导纤维 |
8.下列各醇中,既能发生消去反应,又能发生催化氧化反应的是( )
| A. | CH3OH | B. | 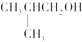 | C. | 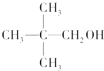 | D. | 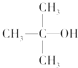 |
15.标准状况下,将5.6L由CO、CH4、C2H4、C2H2组成的混合气体与18L O2置于某密闭容器中点燃,完全反应后恢复到初始状况,得7.5LCO2,则下列判断正确的是( )
| A. | 完全反应后不可能有O2剩余 | |
| B. | 原混合气体中C2H4与C2H2的体积共为1.9L | |
| C. | 完全反应后生成水的质量为9 g | |
| D. | 原混合气体中CO与CH4的体积之比一定为1:1 |
13.下列电子式书写错误的是( )
| A. |  | B. | N??N | C. |  | D. |  |
