题目内容
18.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是( )| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z的原子半径r(T)>r(W)>r(Z) | |
| B. | 由X、Y、Z氢化物的热稳定性X>Y>Z | |
| C. | X最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | W元素的单质具有半导体的特性,可以用于制造光导纤维 |
分析 W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,以此解答该题.
解答 解:W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,
A.同周期自左而右原子半径减小,电子层越多原子半径越大,则原子半径r(T)>r(W)>r(Z),故A正确;
B.同周期元素从左到右,元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增强,则Y>X,故B错误;
C.W为Si、X为N,最高价氧化物对应的水化物的酸性硝酸比硅酸强,故C错误;
D.W为Si,对应的单质具有半导体的特性,对应的化合物二氧化硅可以用于制造光导纤维,故D错误.
故选A.
点评 本题为考查原子结构与元素周期率知识,为高考常见题型,把握短周期及最外层电子数的关系推断元素为解答的关键,涉及元素周期律,综合性较强,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
14.下列物质能发生消去反应的是( )
| A. | CH3Br | B. | 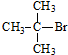 | C. | (CH3)3CCH2Br | D. | 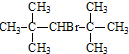 |
6.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
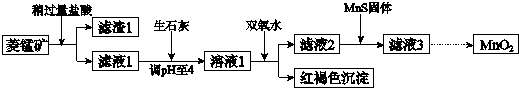
已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).

已知:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
13.某烃的结构简式为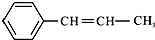 ,它可能具有的性质是( )
,它可能具有的性质是( )
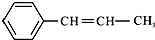 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 不溶于水,易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为: | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
3.下列说法中不正确的是( )
| A. | 原子晶体的熔点一定比分子晶体高 | |
| B. | SO2和SO3均是非极性分子 | |
| C. | PCl3分子中P-Cl的键角小于109°28? | |
| D. | 晶体中有阳离子必有阴离子 |
10.下列有关Ksp的叙述中正确的是( )
①Ksp大的电解质,其溶解度一定大
②Ksp只与电解质的本性有关,而与外界条件无关
③Ksp表示难溶电解质在水中达到沉淀溶解平衡时,溶液中离子浓度计量数次幂之积
④Ksp的大小与难溶电解质的性质和温度有关.
①Ksp大的电解质,其溶解度一定大
②Ksp只与电解质的本性有关,而与外界条件无关
③Ksp表示难溶电解质在水中达到沉淀溶解平衡时,溶液中离子浓度计量数次幂之积
④Ksp的大小与难溶电解质的性质和温度有关.
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
7.下列各组液体只用一种试剂无法鉴别的是( )
| A. | 乙醇、甲苯、硝基苯 | B. | 苯、苯酚、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 苯酚、硫氰化钾溶液、氢氧化钠溶液 |
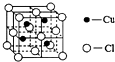 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.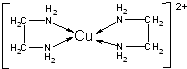
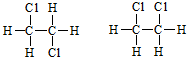 ⑤
⑤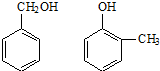 ⑥
⑥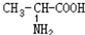 与
与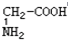
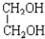 与
与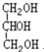 ⑧
⑧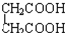 与
与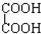 ⑨C3H6与C4H8.
⑨C3H6与C4H8.