题目内容
13.下列电子式书写错误的是( )| A. |  | B. | N??N | C. |  | D. | 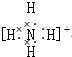 |
分析 首先判断微粒的类型,离子化合物阴离子、复杂阳离子用“[]”并在右上角标注所带电荷,共价化合物不带电荷,注意各原子或离子满足稳定结构.
解答 解:A、水为共价化合物,其中O分别与2个H形成共价键,电子式为 ,故A正确;
,故A正确;
B、氮原子最外层有5个电子,要达到稳定结构得形成三对共用电子对,氮的孤对电子不能省略,正确应为 ,故B错误;
,故B错误;
C、氢氧根是原子团阴离子,要用中括号括起来,并在右上角表明电荷数,故C正确;
D、NH4+为复杂阳离子,电子式中要带电荷,并用[],电子式为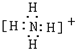 ,故D正确,
,故D正确,
故选B.
点评 本题考查电子式的判断,要明确用电子式表示离子化合物、共价化合物、阴离子及单质分子的方法.过氧根离子中有一对共用电子对.

练习册系列答案
相关题目
3.下列说法中不正确的是( )
| A. | 原子晶体的熔点一定比分子晶体高 | |
| B. | SO2和SO3均是非极性分子 | |
| C. | PCl3分子中P-Cl的键角小于109°28? | |
| D. | 晶体中有阳离子必有阴离子 |
4. 按要求回答下列各题:
按要求回答下列各题:
(1)现有六种物质:①干冰;②金刚石;③四氯化碳;④氯化钙;⑤二氧化硅;⑥硫酸镁.请用编号填写下列空白:
(Ⅰ)熔化时需要破坏共价键的化合物是⑤
(Ⅱ)属于分子晶体且分子空间构型为直线型的是①,其电子式为
(Ⅲ)含有共价键的离子化合物是⑥.
(2)短周期中金属性最强的元素是Na(填元素符号);画出周期表中第三周期第VA族元素原子的结构示意图 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
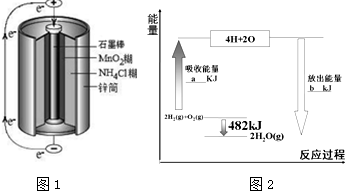
(3)锌锰干电池是最早使用的化学电源,其基本构造如图1所示.该电池的负极材料是Zn,若电路中通过0.4mole-,负极质量减少13g.工作时NH4+在正极放电产生两种气体,其中一种气体分子含10e-的微粒,正极的电极反应式为2NH4++2e-═2NH3↑+H2↑.
(4)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
根据图2中能量变化图,回答下列问题:
①图中:a=1370. ②表格中:X=463.
 按要求回答下列各题:
按要求回答下列各题:(1)现有六种物质:①干冰;②金刚石;③四氯化碳;④氯化钙;⑤二氧化硅;⑥硫酸镁.请用编号填写下列空白:
(Ⅰ)熔化时需要破坏共价键的化合物是⑤
(Ⅱ)属于分子晶体且分子空间构型为直线型的是①,其电子式为

(Ⅲ)含有共价键的离子化合物是⑥.
(2)短周期中金属性最强的元素是Na(填元素符号);画出周期表中第三周期第VA族元素原子的结构示意图
 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)(3)锌锰干电池是最早使用的化学电源,其基本构造如图1所示.该电池的负极材料是Zn,若电路中通过0.4mole-,负极质量减少13g.工作时NH4+在正极放电产生两种气体,其中一种气体分子含10e-的微粒,正极的电极反应式为2NH4++2e-═2NH3↑+H2↑.
(4)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ•mol-1 | 436 | 498 | X |
①图中:a=1370. ②表格中:X=463.
18.下列各组物质,用一种试剂无法区别的是( )
| A. | 三种浓酸:HNO3、H2SO4、HCl | |
| B. | 四种无色溶液:(NH4)2SO4、NH4Cl、Na2SO4、NaCl | |
| C. | 四种黑色粉末:FeO、Fe、CuO、C | |
| D. | 四种无色溶液:KCl、NaOH、K2SO4、NaNO3 |
5.2013年3月19日我国宣布研制出“全碳气凝胶”,其密度是0.16mg/cm3,成为已知的最轻固态材料.对这种物质的认识正确的是( )
| A. | 是碳元素的一种同素异形体 | B. | 是碳元素的一种同位素原子 | ||
| C. | 全部由12C组成 | D. | 能溶于水 |
2.下列有关电池的说法不正确的是( )
| A. | 锌锰干电池中,锌电极是负极 | |
| B. | 手机上用的锂离子电池属于二次电池 | |
| C. | 甲烷燃料电池可把化学能转化为电能 | |
| D. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
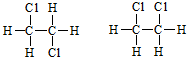 ⑤
⑤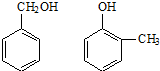 ⑥
⑥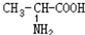 与
与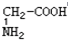
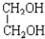 与
与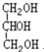 ⑧
⑧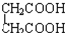 与
与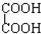 ⑨C3H6与C4H8.
⑨C3H6与C4H8.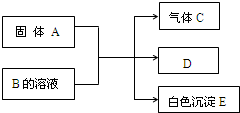 A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示,其中A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液.
A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示,其中A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液. .
.