题目内容
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由此可知说法错误的是( )
| W | X | |
| | Y | Z |
A.原子半径大小:W>X
B.元素最高正价:W>Z
C.简单阴离子的还原性:Y>Z
D.气态氢化物的稳定性:X>Y
B
解析试题分析:A.W、X是同一周期的元素,原子序数越大,原子半径就越小。因此原子半径:W >X。正确。B.假设W的原子最外层电子数为a,则X为(a+1);Y为(a+1)=;Z为(a+2). 由于这四种元素原子的最外层电子数之和等于24。所以a=5.因此W是N;X是O;Y是S;Z是Cl.N的最高化合价为+5价;Cl的最高化合价为+7价,因此元素最高正价:Z >W。错误。C.同一周期的元素,从左到右,元素的非金属性逐渐增强。元素的非金属性越强,其简单离子的还原性就越弱。故简单阴离子的还原性:S2->Cl-.正确。D.X、Y是同一主族的元素,从上到下,元素的非金属性逐渐减弱。元素的非金属性越强,其氢化物的稳定性就越强。因此气态氢化物的稳定性H2O>H2S。正确。
考点:考查元素周期表、元素周期律的应用的知识。

下列排列顺序正确的是
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④失电子能力:Na>Mg>Al
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2
| A.②④⑤ | B.①②④ | C.②③⑤ | D.全部正确 |
短周期元素X、Y、Z的原子序数依次增大,Y为ⅠA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13,下列判断正确的是( )
| A.Y元素位于第2周期 | B.Y、Z均能与X形成不只一种化合物 |
| C.X是VA族元素 | D.氢化物的稳定性:HnZ > HnX |
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④结合质子能力:OH->CH3COO->Cl-
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2
| A.②④⑤ | B.①②④ | C.③⑤ | D.全部正确 |
根据表中提供的部分短周期元素原子半径及主要化合价的信息,判断以下叙述中正确的是:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L>Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
北京时间2012年9月14日,国外媒体报道,美国宇航局的“好奇”号火星车已经展开它的X射线分析器,并首次完成对火星物质元素成分的分析。下面这张图显示的是α粒子与X射线分光仪从某仪器获得的元素分析数据。多个峰值表明各种成分非常丰富,其中包括在火星大气里发现的氩,该仪器自身的铝,以及火星土壤微粒所含的硫黄和氯.
理解此图,判断下列说法错误的是
| A.峰值最高的过渡元素在周期表中的位置是第四周期第Ⅷ副族 |
B.上述元素分析图中,同一周期的两种主族元素可形成1∶1型离子化合物只有一种,其电子式为 |
| C.氯比硫的非金属性强的依据之一是HCl比H2S稳定 |
| D.工业上常用电解氧化铝的方法制备铝 |
是部分短周期元素化合价与原子序数的关系图,下列说法正确的是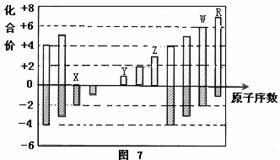
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R>W |
| C.WX和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物相互不能反应 |