题目内容
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④失电子能力:Na>Mg>Al
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2
| A.②④⑤ | B.①②④ | C.②③⑤ | D.全部正确 |
A
解析试题分析:①HF的稳定性大于H2O,错误;②原子半径电子层数越多半径越大,核电荷数越大,半径越小,Na>Mg>F,正确;③同周期元素的非金属性随核电荷数增加而增强,所以最高价含氧酸的酸性增强,错误;④同周期元素,核电荷数增多,失电子能力减弱,正确;⑤熔点:原子晶体>离子晶体>分子晶体,二氧化硅是原子晶体,氯化钠是离子晶体,四氯化碳、二氧化硫是分子晶体,且二氧化硫是气体,正确,答案选A。
考点:考查元素周期律的应用,熔点高低的比较

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示,则下列各项判断正确的是( )
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
B.第三组与第四组相比较,化合物的稳定顺序为:HBr<d
C.第三组物质溶于水后,溶液的酸性c最强
D.第四组物质中H2O的沸点最高,是因为H2O分子间存在氢键
a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示。下列叙述正确的是( )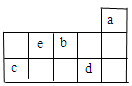
| A.b元素除0价外,只有一种化合价 |
| B.五种元素中,c元素的单质性质最稳定 |
| C.d气态氢化物的水溶液既有氧化性也有还原性 |
| D.e元素最高价氧化物对应的水化物是一种强酸,保存在无色试剂瓶里 |
运用元素周期律分析下面的推断,其中错误的是( )
| A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体 |
| B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
几种短周期元素的原子半径及主要化合价如下表
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列说法正确的是
A.L、T形成的简单离子核外电子数相等
B.R的氧化物对应的水化物呈强碱性
C.X单质在氧气中燃烧生成XO3
D.离子半径大小:r(M3+)> r(T2-)
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由此可知说法错误的是( )
| W | X | |
| | Y | Z |
A.原子半径大小:W>X
B.元素最高正价:W>Z
C.简单阴离子的还原性:Y>Z
D.气态氢化物的稳定性:X>Y
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
| A.X、Y、Z中最简单氢化物稳定性最弱的是Y |
| B.Z元素氧化物对应水化物的酸性一定强于Y |
| C.X元素形成的单核阴离子还原性强于Y |
| D.Z元素单质在化学反应中只表现氧化性 |
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm +和Yn - 的核外电
子排布相同,则下列关系式正确的是( )
| A.a = b+m+n | B.a = b-m+n | C.a = b+m-n | D.a=b-m-n |
1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一种是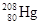 ,它的中子数为:
,它的中子数为:
| A.80 | B.288 | C.208 | D.128 |