题目内容
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④结合质子能力:OH->CH3COO->Cl-
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2
| A.②④⑤ | B.①②④ | C.③⑤ | D.全部正确 |
A
解析试题分析:①F的非金属性强于O,所以热稳定性:HF> H2O>H2S,错误;②原子半径:Na>Mg>F,符合原子半径的判断,正确;③P、S、Cl的非金属性逐渐增强,所以酸性增强:H3PO4<H2SO4<HClO4,错误;④水是中性,醋酸是弱酸,盐酸是强酸,酸性越强,结合质子的能力越弱,所以结合质子能力:OH->CH3COO->Cl-,正确;⑤二氧化硅是原子晶体,熔点最高,氯化钠是离子晶体,熔点其次,四氯化碳和二氧化硫都是分子晶体,但常温下,四氯化碳是液态,二氧化硫是气态,前者熔点高,正确,所以答案选A。
考点:考查元素周期律的应用,熔点高低的比较,酸性的强弱

练习册系列答案
相关题目
对于元素周期表, 下列叙述中不正确的是( )
| A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 |
| C.在金属元素区域可以寻找制备新型农药材料的元素 |
| D.元素周期表是元素周期律的具体表现形式 |
运用元素周期律分析下面的推断,其中错误的是( )
| A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体 |
| B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由此可知说法错误的是( )
| W | X | |
| | Y | Z |
A.原子半径大小:W>X
B.元素最高正价:W>Z
C.简单阴离子的还原性:Y>Z
D.气态氢化物的稳定性:X>Y
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
| A.X、Y、Z中最简单氢化物稳定性最弱的是Y |
| B.Z元素氧化物对应水化物的酸性一定强于Y |
| C.X元素形成的单核阴离子还原性强于Y |
| D.Z元素单质在化学反应中只表现氧化性 |
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm +和Yn - 的核外电
子排布相同,则下列关系式正确的是( )
| A.a = b+m+n | B.a = b-m+n | C.a = b+m-n | D.a=b-m-n |
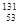 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中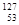 相同 B
相同 B